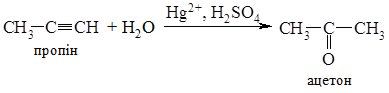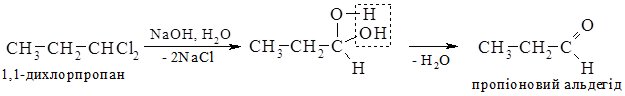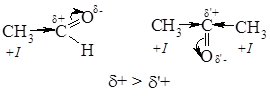Способи добування. 1. Окиснення спиртів. Первинні спирти окиснюються до альдегідів, а вторинні – до кетонів.
1. Окиснення спиртів. Первинні спирти окиснюються до альдегідів, а вторинні – до кетонів.
2. Гідратація алкінів (реакція Кучерова). З ацетилену в умовах реакції утворюється ацетальдегід, всі інші алкіни дають кетони:
Гідратацією ацетилену в промисловості одержують оцтовий альдегід, а з нього відновленням – етиловий спирт; окисненням – оцтову кислоту. 3. Гідроліз дигалогеналканів. При гідролізі дигалогеналканів з атомами галогену біля первинного атома Карбону утворюються альдегіди, а біля вторинного – кетони. Особливо легко гідроліз відбувається в лужному середовищі:
4. Оксосинтез. В промисловості альдегіди одержують взаємодією алкенів з карбон (ІІ) оксидом, воднем при підвищених температурі та тиску в присутності платинового або кобальтового каталізаторів. Зазвичай утворюється суміш ізомерів:
Фізичні та хімічні властивості Мурашиний альдегід – газ, нижчі альдегіди і кетони – леткі рідини. Альдегіди і кетони добре розчиняються в органічних розчинниках, нижчі – розчинні у воді. Більшість альдегідів і кетонів мають характерний запах. Альдегіди, що містять 8 – 12 атомів Карбону – пахучі речовини, їх використовують у парфумерії. Хімічні властивості альдегідів та кетонів визначаються наявністю в їх складі карбонільної групи. Атоми Карбону та Оксигену в карбонільній групі перебувають у стані sp2 ‑гібридизації і зв’язані подвійним зв’язком, який складається з s- та p‑зв’язків. Атом Оксигену, як більш електронегативний, зміщує на себе електронну густину подвійного зв’язку. Внаслідок цього на атомі Карбону утворюється частковий позитивний (δ+), а на атомі Оксигену частковий негативний заряд (δ–):
Завдяки такій поляризації карбонільної групи, альдегіди і кетони є високореакційноздатними сполуками і вступають у реакції приєднання з реагентами, що мають неподілену пару електронів, або молекули яких містять атом з підвищеною електронною густиною або атом з негативним зарядом. Реакція починається з атаки атома Карбону карбонільної групи. Тому реакційна здатність карбонільних сполук в реакціях приєднання визначається величиною часткового позитивного заряду (δ+) на атомі карбону С=О-групи: чим він більший, тим вища їх реакційна здатність. Альдегіди, як правило, більш реакційноздатні, ніж кетони. Алкільні радикали за рахунок +І -ефекту зміщують електронну густину у бік С=О-групи, зменшуючи позитивний заряд на атомі Карбону карбонільної групи. Наявність в молекулі кетону двох алкільних груп біля карбонільної групи, веде до більшого зниження величини позитивного заряду, ніж в молекулі альдегіду.
Всі реакції альдегідів та кетонів можна умовно поділити на групи: – реакції приєднання; – реакції окиснення і відновлення; – реакції полімеризації. Реакції приєднання.
Реакція прискорюється в присутності основи; утворені ціангідрини використовують в синтезі гідрокси- та амінокислот. 2. Приєднання натрій гідроген сульфіту до альдегідів і найпростіших кетонів веде до утворення “бісульфітних сполук”. Реакція проходить без каталізатора.
Бісульфітні сполуки погано розчинні у воді, тому ця реакція є якісною на карбонільну групу, також її використовують для виділення і очищення альдегідів і кетонів. 3. При взаємодії з амоніаком альдегіди утворюють альдіміни.
Альдіміни – нестійкі сполуки, вони самовільно полімеризуються (циклізуються). Три молекули ацетальдіміну самовільно циклізуються з утворенням альдегідаміаку:
4. При взаємодії карбонільних сполук з гідроксиламіном (NH2OH) утворюються оксими, у випадку альдегідів – альдоксими, кетонів – кетоксими.
Альдоксими і кетоксими – тверді кристалічні речовини з чіткими температурами плавленнями, реакцію їх утворення використовують для виділення та ідентифікації альдегідів і кетонів. Реакції відновлення та окиснення. 1. Реакції відновлення альдегідів та кетонів широко застосовують для одержання спиртів (альдегіди відновлюються до первинних, а кетони – до вторинних спиртів). У промисловості проводять гідрування карбонільних сполук у присутності каталітичних кількостей кобальту, нікелю або платини:
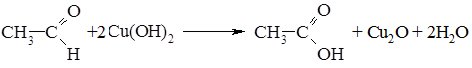
2. Окиснення альдегідів та кетонів відбувається по-різному. Альдегіди дуже легко окиснються, навіть при дії слабких окисників (Ag+, Cu+), вони перетворюються в карбонові кислоти:
Реакцію окиснення альдегідів амоніачним розчином аргентум (І) оксиду називають реакцією “срібного дзеркала”. Іон Аргентуму в цій реакції відновлюється до вільного металу, яке виділяється у вигляді дзеркала на стінках пробірки. Окиснення кетонів відбувається лише сильними окисниками – калій перманганатом або дихроматом, реакція супроводжується розривом зв’язків С‑С у молекулі кетону. Реакції полімеризації. Альдегіди, на відміну від кетонів здатні полімеризуватись. Процес проходить за звичайних умов і прискорюється кислотами. Полімеризація формальдегіду проходить з утворенням полімеру лінійної структури:
Полімеризація ацетальдегіду за наявності слідів сульфатної кислоти веде до утворення циклічного продукту – тримеру – паральдегіду:
|