Обучающие упражнения и задачи с решением
1. Укажите координационное число и степень окисления центрального атома металла в следующих координационных соединениях: а) K3[Fe(CN)6]; б) Na3[Cr(C2O4)3]; в) [Pt(NH3)4Cl2]Cl2. Решение: Исходя из определения, что координационное число (к.ч.) – это число связей комплексообразователя с лигандами, а суммарный заряд комплексного соединения равен 0, устанавливаем: а) к.ч. = 6, т.к. CN– -монодентатный лиганд; Fe +3, т.к. заряд внешней сферы +3, а суммарный заряд лигандов – 6; б) к.ч. = 6, т.к. C2O42– – бидентатный лиганд; Cr+3, т.к. заряд внешней сферы +3, а суммарный заряд лигандов – 6; в) к.ч. = 6, т.к. NH3 и Cl– – монодентатные лиганды; Pt+4, [Pt+4(NH30)4Cl–2]+2(Cl2)–
2. Назовите каждое из следующих соединений: а) [Co(NH3)5Cl]2+; б) K4[Fe(CN)6]; в) [Ni(CO)5]. Решение: а) хлоропентаамминкобальт(III)-ион; б) гексацианоферрат(II) калия; в) пентакарбонилникель.
3. Напишите формулы соединений по их названиям: а) тетрацианоникелат(II) цезия; б) бромид дибромотетраамминхрома(III). Решение: а) Cs2[Ni(CN)4]; б) [Cr(NH3)4Br2]Br.
4. Для указанных комплексных соединений определите заряд лигандов и их дентатность: а) K2[PtCl6]; б) K3[Fe(CN)6]; в) Na2[Ni(CO3)2]. Решение: а) –1; моно-; б) –1; моно-; в) –2; би-.
5. Приведите молекулярно-ионные уравнения первичной и вторичной диссоциации комплексных соединений: [Ag(NH3)2]Cl, [Pt(NH3)3Cl]Cl. Решение: [Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl– – первичная дисоциация [Ag(NH3)2]+ Ag+ + 2NH3 – вторичная диссоциация K н = [Pt(NH3)3Cl]Cl ® [Pt(NH3)3Cl]+ + Cl– – первичная диссоциация [Pt(NH3)3Cl]+ Pt2+ + 3NH3 + Cl– – вторичная диссоциация K н =
6. Какова роль центрального атома в образовании донорно-акцепторной связи? Объясните на примере K3[Al(OH)6]. Решение: Акцептор электронных пар (кислота Льюиса) – Al3+
7. K н иона [Ag(CN)2]– = 1×10–21. Рассчитайте концентрацию ионов серебра в 0,05М растворе К[Ag(CN)2], содержащем кроме того 0,01 моль/л KCN. Решение: Вторичная диссоциация комплексного иона протекает по уравнению: [Ag(CN)2]– Ag+ + 2CN– В присутствии избытка ионов CN–, создаваемого в результате диссоциации KCN (a = 1), это равновесие смещено влево настолько, что количеством ионов CN– образовавшихся при вторичной диссоциации можно пренебречь. Тогда с (CN–) = с (KCN) = 0,01 моль/л. Концентрация ионов [Ag(CN)2]– может быть приравнена к общей концентрации комплексной соли – 0,05 моль/л. K н = [Ag+] =
8. Вычислите массу серебра, содержащегося в виде ионов в растворе хлорида диамминсеребра(I) c концентрацией 0,03 моль/л объемом Решение: Вторичная диссоциация комплексного иона протекает по уравнению: [Ag(NH3)2]+ Ag+ + 2NH3 В присутствии избытка ионов NH3, количеством ионов NH3, образовавшихся в результате вторичной диссоциации комплексного иона можно пренебречь, тогда [NH3] = c (NH3) = 0,1 моль/л. Концентрация ионов [Ag(NH3)2]+ может быть приравнена общей концентрации комплексной соли – 0,03 моль/л. K н = [Ag+] = m (Ag) = M (Ag+)× V×c (Ag+)=108 г/моль×0,75 л×1,77×10–7 моль/л=1,43×10–5 г.
9. Определите степень диссоциации и концентрацию ионов и молекул в 0,1М растворе [Zn(NH3)4]SO4, K н = 2,6×10–10. Решение: Диссоциация соли протекает по уравнению: [Zn(NH3)4]SO4 ® [Zn(NH3)4]2+ + SO Поэтому с([Zn(NH3)4]2+) = 0,1 моль/л, с(SO Вторичная диссоциация протекает по уравнению: [Zn(NH3)4]2+ Zn2+ + 4NH3 (2) K н = Из уравнения (2) следует, что [Zn2+] = 4[NH3]. Обозначив [Zn2+] = х моль/л, получим K н = Так как K н имеет низкое значение, то можно принять (0,1 – х)» 0,1, тогда имеем: Решая уравнение, получаем х = 2,52×10-3 моль/л. Степень диссоциации комплексного иона: a =
10. Можно ли растворить 0,5 моль AgI в растворе аммиака с конечной концентрацией NH3 равной 1 моль/л. Ks (AgI) = 1,5×10–16, K н ([Ag(NH3)2]+) = 6,8×10–8. Решение: Растворение AgI может быть связано с образованием комплексного иона [Ag(NH3)2]+, при этом его концентрация при полном растворении должна быть 0,5 моль/л. Обозначим концентрацию Ag+ в растворе диаммиаката серебра через х моль/л, с(NH3) = 1 моль/л (по условию), тогда K н = с(Ag+) = 3,4×10–8М. В насыщенном растворе AgI с (Ag+)= Так как 3,4×10–8 > 1,22×10–8, то растворение AgI в растворе аммиака не произойдет.
11. Может ли уксусная кислота разрушить комплекс [Ag(NH3)2]Cl? Решение: Запишем уравнения реакций: [Ag(NH3)2]+ Ag+ + 2NH3 (1) Константа этой реакции равна K 1 = K н([Ag(NH3)2]+)= 5,9·10–8. CH3COOH CH3COO– + H+ (2) Константа этой реакции равна K 2 = K a(CH3COOH)= 1,74·10–5. Конкурируют два процесса: лигандообменный и протолитический. Объектом конкуренции является аммиак а) NH3 + H+ NH4+ (3) эта реакция характеризуется K 3 = 1/ K a(NH4+) где K a(NH4+) = 5,75·10–10; б) 2NH3 + Ag+ [Ag(NH3)2]+. Складывая уравнение реакции (1) с уравнениями (2) и (3), коэффициенты которых удвоены, получим суммарную реакцию: [Ag(NH3)2]+ + 2CH3COOH Ag+ + 2CH3COO– + 2 NH4+, константа равновесия которой равна
Полученный результат (K > 1) свидетельствует о том, что при с.у. произойдет разрушение комплекса уксусной кислотой, равновесие суммарной реакции сдвинуто вправо. 12. Можно ли разрушить комплекс [Ag(NH3)2]+, концентрация которого в растворе составляет 0,1 моль/л, добавлением раствора KCl равного объема и равной концентрации? Увеличение объема при сливании исходных растворов можно не учитывать. Решение: Пусть концентрация ионов серебра равна Х, тогда: [Ag(NH3)2]+ Ag+ + 2NH3 0,1–х х 2х Диссоциация комплексного иона не велика, поэтому разность (0,1 – Х) можно принять равной 0,1. K н = х = 1,22×10–3. K s(AgCl) = 1,78·10–10, Пс = 1,22×10–3 × 0,1 = 1,22×10–4. Таким образом Пс > K s, а, следовательно комплекс в отсутствие избытка аммиака ионами хлора разрушается.
|





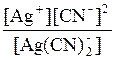 = 1×10-21;
= 1×10-21; ; [Ag+] =
; [Ag+] = 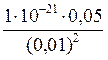 = 5×10–19 моль/л.
= 5×10–19 моль/л. ; [Ag+] =
; [Ag+] =  ;
;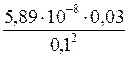 = 1,77×10–7 моль/л;
= 1,77×10–7 моль/л; (1)
(1) = 2,6×10-10
= 2,6×10-10 .
.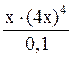 = 2,6×10-10.
= 2,6×10-10. ; a =
; a = 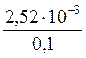 = 0,0252 = 2,52%
= 0,0252 = 2,52% ; 6,8×10–8 =
; 6,8×10–8 = 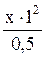 , х = 3,4×10–8 моль/л;
, х = 3,4×10–8 моль/л; =
=  =1,22×10–8 моль/л.
=1,22×10–8 моль/л.

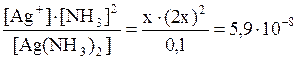 , отсюда 4х3 = 0,59×10–8.
, отсюда 4х3 = 0,59×10–8.


