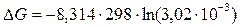Типовые задачи с решением. На основании уравнения изотермы
1. В каком направлении пойдет реакция, если смешать реагенты в указанных концентрациях: тетраамминмедь(II)-ион медь(II)-ион + аммиак 0,1 моль/л 0,0000001 моль/л 2 моль/л Решение: Для ответа на вопрос задачи надо воспользоваться уравнением изотермы химической реакции: D G = – RTlnKн + RT ln Пс, т.е. вычислить Пс и сравнить его с табличным значением константы. Поскольку записанный процесс представляет собой полную диссоциацию комплексного иона, Пс надо сравнить с константой нестойкости тетраамминмеди(II). В случае Пс < K н пойдет прямой процесс, т. е. положение равновесия сместится вправо; в случае Пс > K н – влево. Пс = Табличное значение константы нестойкости иона 9,33×10–13. Поскольку Пс > K н, положение равновесия сместится влево.
2. Можно ли разрушить комплекс [Ag(NH3)2]Cl, концентрация которого в растворе равна 0,2 М, приливая к 100 мл его раствора 100 мл 0,2 М уксусной кислоты? Температура равна 25°С. Решение: В растворе, в котором одновременно находится и комплексное соединение [Ag(NH3)2]Cl и уксусная кислота CH3COOH протекает реакция диссоциации комплексного иона [Ag(NH3)2]+ Ag+ + 2NH3 (1) Константа равновесия этой реакции равна константе нестойкости этого комплексного иона K 1 = K н([Ag(NH3)2]+) = 5,9·10–8. Константа диссоциации уксусной кислоты по реакции CH3COOH CH3COO– + H+ (2) равна K 2 = Ka (CH3COOH) = 1,74·10–5. Так как продукты этих реакций реагируют между собой NH3 + H+ NH4+ (3) то протолитический процесс (3) конкурирует с лигандообменным (1). Объектом конкуренции является аммиак Константа равновесия реакции (3) равна K 3 = 1/ Ka (NH4+) где Ka (NH4+) = 5,75·10–10; Для того, чтобы составить уравнение разрушения комплексного иона под действием уксусной кислоты и рассчитать константу равновесия этой реакции, применим известный метод комбинирования равновесий. Удваивая коэффициенты уравнений реакций (2) и (3) и складывая эти реакции с реакцией (1), получим суммарное уравнение [Ag(NH3)2]+ + 2CH3COOH Ag+ + 2CH3COO– + 2NH4+ (4) Константа равновесия реакции (4) связана с константами реакций (1) – (3) соотношением
Чтобы ответить на вопрос о возможности протекания реакции разрушения комплексного иона, необходимо использовать уравнение изотермы химической реакции (в условиях обычного лабораторного опыта постоянны давление и температура, а среди продуктов и реагентов нет газообразных веществ)
Концентрации ионов и веществ во втором слагаемом – начальные концентрации в момент сливания растворов. Рассчитаем их значения. В первый момент после сливания исходных растворов равновесные концентрации участников реакции (1) связаны уравнением
Рассчитаем их, обозначая равновесную концентрацию ионов Ag+, образовавшихся при диссоциации комплексного иона через х. Тогда равновесная концентрация NH3 в соответствии с уравнением (1) равна 2 х. Равновесная концентрация комплексного иона [Ag(NH3)2]+ равна
Предположим, что 0,1 >> x, тогда это уравнение упрощается х = 1,14×10–3 М. Таким образом, исходная концентрация ионов серебра равна Аналогичным образом рассчитаем начальные концентрации участников реакции (2). В первый момент после сливания исходных растворов равновесные концентрации участников реакции (2) связаны уравнением:
Обозначим равновесную концентрацию иона Н+ в исходном растворе через х. Тогда концентрация ацетатного иона также равна х, концентрация оставшейся уксусной кислоты 0,1 – х. Подставляя эти значения и значение константы в уравнение (8) получим уравнение
Предположим, что 0,1 >> x, тогда это уравнение упрощается х 2 = 1,74×10–5×0,1 или х = 1,32×10–3. Таким образом, исходная концентрация ионов водорода и ацетатных ионов равна 1,32×10–3 М. Предположим, что в момент смешения ионы водорода (они находятся в недостатке по отношению к молекулам аммиака в реакции (3)) полностью прореагируют с молекулами аммиака (константа равновесия этой реакции имеет очень большую величину). Тогда концентрация образовавшихся ионов аммония равна 1,32×10–3 М. Подставляя величину константы K 4 и концентрации всех участников реакции (4) в уравнение (5), получим
Столь большое отрицательное значение D G свидетельствует о том, что реакция (4) после смешения исходных растворов будет протекать слева направо, то есть уксусная кислота разрушает комплекс.
3. Будет ли растворяться хлорид серебра в 0,1 М растворе аммиака? Температура равна 25°С. Решение: Хлорид серебра – малорастворимое вещество, диссоциирующее в растворе по реакции AgClтв Ag+ + Cl– (1) константа равновесия которой равна K 1 = K s = 1,78·10–10. Аммиакат серебра – комплексное соединение, которое образуется в реакции Ag+ + 2NH3 [Ag(NH3)2]+ (2) константа которой равна K 2 = 1/ K н, где K н = 5,9·10–8 – константа нестойкости образующегося комплекса. В данной задаче мы наблюдаем совмещение гетерогенного равновесия и равновесия в реакции комплексообразования. Объектом конкуренции являются ионы серебра. Уравнение реакции суммарного процесса получим, складывая реакции (1) и (2): AgClтв + 2NH3 [Ag(NH3)2]+ + Cl– (3) Константы равновесия этих реакций связаны соотношением: K 3 = K 1 ×K 2 = K s/ K н = 1,78·10–10 / 5,9·10–8 = 3,02·10–3. Чтобы ответить на вопрос о возможности протекания реакции растворения осадка, необходимо использовать уравнение изотермы химической реакции (в условиях обычного лабораторного опыта постоянны давление и температура, а среди продуктов и реагентов нет газообразных веществ)
Концентрации ионов и веществ во втором слагаемом – начальные концентрации в момент сливания растворов. Рассчитаем их значения. Начальные равновесные концентрации ионов серебра и хлора, равные друг другу, рассчитаем по уравнению [Ag+] = [Cl–] = Концентрация образующегося по реакции (2) комплексного иона будет практически равна начальной концентрации иона серебра, так как аммиак взят в большом избытке (0,1 М) по отношению к начальной концентрации ионов серебра (1,33·10–5 М) [[Ag(NH3)2]+] = 1,33·10–5 М. Концентрация аммиака останется практически неизменной (0,1 М). Подставляя величину константы K 3 и концентрации всех участников реакции (3) в уравнение (4), получим
Столь большое отрицательное значение D G свидетельствует о том, что реакция (3) после добавления раствора аммиака к осадку будет протекать слева направо, то есть аммиак разрушает малорастворимое соединение.
Контрольные вопросы, задачи и упражнения
|

 на основании уравнения изотермы
на основании уравнения изотермы = 1,6×10–5
= 1,6×10–5

 (5)
(5)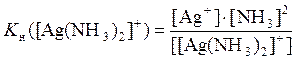 (6)
(6)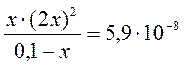 (7)
(7)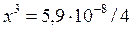 ;
; (8)
(8) (9)
(9)

 (4)
(4) =
=  =1,33·10–5 М.
=1,33·10–5 М.