Примеры тестовых заданий для самоподготовки и контроля
1. Атом какого элемента имеет электронную конфигурацию: 1 s 22 s 22 p 63 s 23 p 64 s 1? 1) Na 2) K 3) Ca 4) Cu 2. Какова формула валентных электронов атома Fe? 1)...4 s 23 d 6 2)...4 s 2 3)...3 d 6 4) …4 s 03 d 8 3. Механизм образования ковалентной связи: а) радикальный б) обменный; в) донорно-акцепторный г) гетеролитический 1) а, г 2) а, б 3) б, в 4) а, в 4. Катионы s -элементов относятся к: 1) «жестким» кислотам Льюиса 2) «жестким» основаниям Льюиса 3) «мягким» кислотам Льюиса 4) «мягким» основаниям Льюиса 5.К ион-дипольным взаимодействиям относятся: 1) Mg2+ + 6H2O ® [Mg(H2O)6]2+ 3) I– + I2 ® I 2) R1– 4) HCl + H2O ® H3O+ + Cl– 6. Антиоксиданты – вещества, вступающие в реакции со свободными радикалами и окислителями, защитники жизненно важных метаболитов. К антиоксидантам относятся: а) глутатион, цистеин; б) витамин С; 1) все 2) а, б, д 3) а, б, в, е 4) а, в, г 7. О кислороде, О2, нельзя сказать: 1) это самая важная для жизни часть воздуха; 2) снижение содержания кислорода в воздухе при нормальном атмосферном давлении от 21% до 15-17% вызывает выраженное ухудшение самочувствия; 3) высокая температура воздуха (35–40оС) и большая влажность вызывают снижение парциального давления кислорода; 4) высокая температура воздуха (35–40оС) и большая влажность вызывают повышение парциального давления кислорода; 5) кислород в чистом виде токсичен. 8. Какие типы реакций в организме катализируют маталлоферменты? а) кислотно-основные б) окислительно-восстановительные в) гетерогенные г) лигандообменные 1) а, б 2) а, б, в 3) б, в, г 4) все 9. На чем основано бактерицидное действие Н2О2: 1) на окислительной способности 3) на восстановительной способности с окислением до О2 4) на окислительной способности и безвредности продуктов восстановления - воды и О2 10. Почему нитриты токсичны и их запрещено добавлять в качестве консервантов в мясопродукты? а) вызывают метгемоглобинемию; б) вызывают кислородное голодание тканей; в) увеличивают свободнорадикальное окисление в организме; г) превращаются в желудке в HNO2, а затем в нитрозоамины – канцерогены. 1) а, б, в, г 2) а, б 3) в, г 4) г 11.Основные физиологические формы гемоглобина: а) оксигемоглобин, гем-Fe2+ – О2; б) карбаминогемоглобин, (глобин-СО2)–; в) карбаминогемоглобин, гем-Fe2+ – СО2; г) карбоксигемоглобин, гем-Fe2+ – СО; д) метгемоглобин, гем-Fe3+ –ОН. 1) все 2) а, в, д 3) а, б, г 4) а, б 12. Почему кислотные дожди – наиболее тяжелая форма загрязнения окружающей среды, опасная болезнь биосферы? а) уменьшается рН пресноводных водоемов, гибнет рыба б) увеличивается рН пресноводных водоемов, гибнет рыба в) повышается растворимость в почве соединений тяжелых металлов г) происходить уменьшение закисления почвы и сточных вод 1) б, в 2) а, г 3) в, г 4) а, в 13.Воздействие загрязненного атмосферного воздуха на здоровье населения имеет особенности: а) разнообразие и необычность многих загрязнений человеческого организма; б) от употребления загрязненных воды или пищи человек может воздержаться, а от воздуха – нет; в) загрязняющие вещества в воздухе находятся в виде твердых частиц и газов; г) наиболее химически активными загрязнителями являются оксиды серы, азота, хлор, фенолы; д) атмосферные загрязнения оказывают чаще быстрое воздействие, чем медленное, но постоянное. 1) все 2) а, б, г 3) б, в, г 4) б, г, д 14. Пути поступления химических элементов в организм человека: а) с пищей; б) с водой; в) с воздухом; г) в виде аэрозолей; д) через кожу; е) лекарства и БАДы. 1) а, б, д 2) а, б, в 3) все 4) а, б, г, е 15. Наибольшей комплексообразующей способностью обладают… 1) d -элементы; 2) р -элементы; 3) s -элементы. 16. Какая связь между комплексообразователем и лигандами? 1) ковалентная по донорно-акцепторному механизму; 2) ковалентная по обменному механизму; 3) ионная. 17. Что такое координационное число? 1) число связей комплексообразователя; 2) число лигандов; 3) число центральных атомов. 18. При образовании комплекса, центральный атом является... 1) донором электронной пары 2) акцептором электронной пары 3) и донором и акцептором электронной пары. 19. При образовании комплекса лиганды являются… 1)донором электронной пары 2) акцептором электронной пары 3) и донором, и акцептором электронной пары. 20. Дентатность - это: а) число связей между комплексообразователем и лигандами; 6) число электронодонорных атомов в лиганде в) число электронодонорных атомов в комплексообразорателе; г) число электроакцепторных атомов в комплексообразователе. 1) а; 2) б; 3) в; 4) г. 21. В хелатные соединения входят: а) монодентатные лиганды; б) бидентатные лиганды; в) полидентатные лиганды; г) би- и полидентатные лиганды. 1) а; 2) б; 3) в; 4) г. 22. Комплексоны - это: а) хелатообразующие би- и полидентатные лиганды - доноры электронных пар; б) органические соединения, способные к образованию комплексных соединений; в) полидентатные лиганды - акцепторы электронных пар. 1) а; 2) б; 3) в. 23. Из перечисленных лигандов выберите монодентатные: а) CN–; б) ОН–, в) CO 1) а, б, д; 2) а, б, в; 3) в, г, д. 24. Определить в соединении К2[NiCl4] степень окисления и тип гибридизации центрального атома. 1) +2, sp3; 2) +2; sp2; 3) +1, sp3d2. 25. Назовите комплексообразователь в гемоглобине: а) Cu0; б) Fe3+; в) Fe2+; г) Zn2+; д) Fe0. 1) а; 2) б; 3) в; 4) г; 5) д. 26. Определить степень окисления центрального атома в соединении [Pt(NH3)2Cl2]. 1) +4; 2) +2; 3) 0. 27. Определить степень окисления центрального атома в соединении [Со(NH3)6]С13. 1) +2; 2) +3; 3) +4; 4) 0. 28. Как можно разрушить комплекс [Ag(NH3)2]С1. 1) добавить HNO3; 2) добавить NaOH; 3) добавить NaCl. 29. Чем меньше K н, тем комплекс более... 1) устойчивый; 2) неустойчивый; 3) устойчивость не определяется величиной K н. 30. Пользуясь соответствующей таблицей справочника, определите самый устойчивый комплекс: а) глицин-Мg2+; б) гистидин-Fе2+; в) аспарагин-Ni2+. 1) а; 2) б; 3) в. 31. Пользуясь соответствующей таблицей справочника, расположите комплексные ионы по увеличению прочности: а) [Cd(CN)4]–; б) [Cu(CN)4]2–; в) [Zn(NH3)4]2+. 1) а, б, в; 2) б, в, а; 3) в, б, а 4) в, а, б 32. Что собой представляет гемоглобин (Нв) по химической природе: а) Нв - сложный белок, содержащий хелатный макроцикл гем с железом в степени окисления +2; б)Нв - кислый белок, содержащий небелковую часть -гем, с железом окисления +3; в) Нв – транспортная форма кислорода, содержащая атом железа в нейтральном состоянии; г) Нв – резервная и транспортная форма кислорода, содержит железо в переменной степени окисления 1) а; 2) б; 3) в, 4) г 33. Противоопухолевым действием обладает: а) цис-изомер [Рt(NH3)2С12]; б) транс-изомер [Рt(NH3)2С12]. 1) а; 2) б. Экзаменационные вопросы (лечебный, педиатрический факультеты) 1. Понятие о биогенности химических элементов. Классификация и распространенность химических элементов в организме человека и в окружающей среде. Эндемические заболевания. 2. Человек и биосфера. Экологические проблемы. Кислотные дожди. Основные виды загрязнений окружающей среды. Смог. 3. Зависимость свойств соединений от природы химической связи на примере N2, HCl, NaCl, (H2O)n. Понятие о межмолекулярных взаимодействиях. 4. Натрий и калий. Строение атомов натрия и калия (электронные и электронно-графические формулы). Натрий и калий в организме человека. Применение соединений натрия и калия в медицине. 5. Строение атомов кальция и магния (электронные и электронно-графические формулы). Биологическая роль кальция и магния, применение их соединений в медицине. 6. Углерод и кремний. Строение атомов. Биогенная роль углерода и кремния. Токсическое действие оксида углерода(II), цианидов. Биологическая роль углерода и кремния, их важнейшие соединения. 7. Азот. Фосфор. Строение атомов, молекул. Биологическая роль азота, фосфора. Применение азота, фосфора и их соединений в медицине. Нитраты и нитриты, их токсическое действие на организм. 8. Кислород, сера. Строение атомов (электронные и электронно-графические формулы), молекулы кислорода. Биологическая роль серы и кислорода. Применение серы и ее соединений в медицине. Оксигенотерапия. 9. Галогены, строение атомов. Важнейшие соединения, биологическая роль. Химический состав слюны. 10. Железо, марганец, хром. Строение атомов (электронные и электронно-графические формулы). Биологическая роль, применение соединений в медицине. 11. Важнейшие микроэлементы; понятие о микроэлементозах. Со, Cu, Zn, их строение, биологическая роль. Применение соединений в медицине. 12. Комплексные соединения. Классификации. Понятие о хелатных и макроциклических соединениях. 13. Характер связей в комплексных соединениях с точки зрения метода валентных связей и теории Льюиса. Поясните на примерах [Ag(NH3)2]+, [Zn(OH)4]2–, [Fe(CN)6]3–; [Pt(NH3)4]2+. Укажите тип гибридизации атомных орбиталей центрального атома, геометрическую конфигурацию комплексных ионов. 14. Устойчивость комплексных соединений в растворах. Напишите уравнения диссоциации комплексных соединений: [Zn(NH3)4]SO4, K 2[Hg(NH3)4], математическое выражение K н и укажите, пользуясь справочником, какой из данных комплексных ионов является наиболее прочным. 15. Гемоглобин как хелатное макроциклическое соединение, его кислотно-основные, окислительно-восстановительные и комплексообразующие свойства. 16. Лигандообменные процессы и равновесия. Изолированные и совмещенные. Примеры. Почему хлорид серебра растворяется в растворе аммиака, а аммиакат серебра можно разрушить с помощью KI. 17. Типы реакций, происходящих в организме: кислотно-основные (протолитические), гетерогенные, комплексообразования (лигандообменные), окислительно-восстановительные (редокс-процессы). Примеры. Конкурирующий характер совмещенных процессов. Примеры совмещенных процессов в организме человека. Объясните возможность растворения гидроксида магния, карбоната кальция добавлением соляной кислоты, а оксалата кальция – перманганатом калия. Совмещение каких процессов наблюдается в данных случаях? 18. В раствор, в котором присутствуют ионы бария, кальция, кобальта(П), добавили ЭДТА. Какие процессы происходят? Объясните суть данного явления. Охарактеризуйте ЭДТА как лиганд. 19. Понятие о металло-лигандном гомеостазе и его нарушениях. Тяжелые металлы, их токсическое действие на организм. Термодинамические принципы хелатотерапии. Экзаменационные вопросы (стоматологический факультет) 1. Понятие о биогенности химических элементов. Классификация и распространенность химических элементов в организме человека и в окружающей среде. Понятие об эндемических заболеваниях. 2. Человек и биосфера. Экологические проблемы глобальные и региональные. Кислотные дожди. 3. Натрия и калий. Строение атомов натрия и калия (электронные и электронно-графические формулы). Натрий и калий в организме человека. Применение соединений натрия и калия в медицине. 4. Строение атомов кальция и магния (электронные и электронно-графические формулы). Биологическая роль кальция и магния, применение их соединений в медицине. Химический состав эмали зуба. 5. Углерод и кремний. Строение атомов. Биогенная роль углерода и кремния. Токсическое действие оксида углерода(II). Биологическая роль углерода и кремния, их важнейшие соединения, применение в стоматологиии. 6. Азот. Фосфор. Строение атомов, молекул. Биологическая роль азота, фосфора. Применение азота, фосфора и их соединений в медицине. Нитраты и нитриты, их токсическое действие на организм. 7. Кислород, сера. Строение атомов (электронные и электронно-графические формулы), молекулы кислорода. Биологическая роль серы и кислорода. Применение серы и ее соединений в медицине. Оксигенотерапия. 8. Галогены, строение атомов. Важнейшие соединения, биологическая роль. Химический состав слюны. Фторсодержащие зубные пасты и стоматологические лаки. 9. Важнейшие микроэлементы: железо, марганец, хром. Строение атомов (электронные и электронно-графические формулы). Биологическая роль, применение соединений в медицине. 10. Важнейшие микроэлементы: Со, Cu, Zn, их строение, биологическая роль. Применение соединений в медицине. Цинк-фосфатные цементы. 11. Общие сведения о сплавах и их свойствах. Сплавы Pd, Fe, Cu, Ag, Au в стоматологической практике. 12. Представление о стоматологических материалах: пломбировочных, слепочных, металлокерамических. 13. Тяжелые металлы, их токсическое действие на организм. 14. Зависимость свойств соединений от природы химической связи в них на примере: N2, H2O, NaCl, (H2O) n. 15. Представление о комплексных соединениях. Классификации. Примеры. 16. Характер связей в комплексных соединениях с точки зрения метода валентных связей. Поясните на примерах: [Ag(NH3)2]Cl, K2[Zn(OH)4], [Pt(NH3)2Cl2], K3[Fe(CN)6]. 17. Понятие о хелатных, макроциклических комплексных соединениях. Гемоглобин как хелатное соединение. 18. Комплексообразующая способность s-, p-, d -элементов. Понятие о металло-лигандном гомеостазе, примеры его нарушения. Принципы хелатотерапии. 19. Для указанных соединений определите: а) заряд внутренней сферы; 20. Устойчивость комплексных соединений в растворах. Напишите уравнения диссоциации комплексных соединений: [Zn(NH3)4]SO4, K2[Hg(CN)4]; выражение K н и укажите какой из комплексных ионов является наиболее прочным, пользуясь справочными данными. Экзаменационные вопросы (медико-профилактический факультет) 1. Понятие о биогенности химических элементов. Классификация и распространенность химических элементов в организме человека и в окружающей среде. Эндемические заболевания. 2. Человек и биосфера. Понятие о биосфере. Атмосфера, строение, химический состав. 3. Источники загрязнения атмосферы: промышленные, транспортные, сельское хозяйство, коммунально-бытовой сектор. 4. Экологические проблемы загрязнения атмосферы: а) токсикантами (углеводородами, свинцом и его оксидами, монооксидами углерода); 5. Методы снижения поступления токсикантов в атмосферу. Контроль загрязнений (традиционные, современные, сенсорные). 6. Загрязнение гидросферы: тяжелыми металлами, ПАВ и синтетическими полимерами, нефтью, кислотными осадками. Общие показатели для природных и сточных вод. 7. Специфические показатели природных вод: жесткость воды, ее виды и способы устранения. 8. Зависимость свойств соединений от природы химической связи в них (N2, H2O, NaCl, (H2O)n). 9. Натрий и калий. Строение атомов натрия и калия (электронные и электронно-графические формулы). Натрий и калий в организме человека. Применение соединений натрия и калия в медицине. 10. Строение атомов кальция и магния (электронные и электронно-графические формулы). Биологическая роль кальция и магния, применение их соединений в медицине. 11. Углерод и кремний. Строение атомов. Биогенная роль углерода и кремния. Токсическое действие оксида углерода(II). Биологическая роль углерода и кремния, их важнейшие соединения. 12. Азот. Фосфор. Строение атомов, молекул. Биологическая роль азота, фосфора. Применение азота, фосфора и их соединений в медицине. Нитраты и нитриты, их токсическое действие на организм. 13. Кислород, сера. Строение атомов (электронные и электронно-графические формулы), молекулы кислорода. Биологическая роль серы и кислорода. Применение серы и ее соединений в медицине. Оксигенотерапия. 14. Галогены, строение атомов. Важнейшие соединения, биологическая роль. Химический состав слюны. 15. Железо, марганец, хром. Строение атомов (электронные и электронно-графические формулы). Биологическая роль, применение соединений в медицине. 16. Важнейшие микроэлементы; понятие о микроэлементозах. Со, Cu, Zn, их строение, биологическая роль. Применение соединений в медицине. 17. Тяжелые металлы, их токсическое действие на организм. Принцип хелатотерапии. 18. Комплексные соединения. Классификации. Гемоглобин как хелатное соединение. 19. Понятие о металло-лигандном гомеостазе и его нарушениях. 20. Для указанных комплексных соединений определите: а) заряд внутренней сферы; б) степень окисления центрального атома; в) координационное число центрального атома; г) заряд лигандов и их дентатность: [Cr(NH3)6]SO4, K2[Zn(OH)4], [Ag(NH3)2]OH, [Pt(NH3)4]Cl2. 21. Характер связей в комплексных соединениях с точки зрения метода валентных связей. Поясните на примере [Ag(NH3)2]Cl. 22. Устойчивость комплексных соединений в растворах. Напишите уравнения диссоциации комплексных соединений: [Zn(NH3)4]SO4, K2[Hg(CN)4], математическое выражение К н и укажите, какой из комплексных ионов является наиболее прочным, если их К н соответственно равны: 4×10-10, 4×10-4. 23. Укажите тип гибридизации атомных орбиталей центрального атома в комплексных соединениях и геометрическую конфигурацию комплексных ионов: [Co(NH3)6]3+; [Pt(NH3)4]2+, [Zn(OH)4]2–; [Ag(NH3)2]+. 24. Один из методов удаления SO2 из продуктов сгорания топлива основан на реакции поглощения его негашеной известью. Рассчитайте, сколько карбоната кальция потребуется для улавливания SO2, образующегося при сгорании 1 т нефти, если w(S) в ней составляет 1,7% (предположить, что эффективность этого способа удаления SO2 составляет 22%). 25. Для определения активного хлора в воде к пробе объемом 50 мл добавили избыток иодида калия и соляную кислоту. На титрование выделившегося иода израсходовали 18,20 мл раствора тиосульфата натрия с концентраций 0,01 моль/л. Вычислите массу активного хлора в 1 л воды. 26. В 4 м3 воды содержатся Са(НСО3)2 массой 648 г и CaCl2 массой 1335 г. Определите общую жесткость (Жо) воды?
|

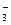
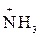 + R2–COO– ® R2–CO–NH–R1 + H2O
+ R2–COO– ® R2–CO–NH–R1 + H2O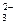 , г) C2O
, г) C2O 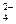 ; д) NO
; д) NO 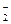 .
.


