| Название этапа
| Описание деятельности
| Цель деятельности
| время
|
| 1. Теоретические аспекты классификации соединений.
| Задание № 1.
1.Что такое химическое соединение. Приведите примеры?
2.Что такое металлы. Их свойства?
3. Неметаллы. Характеристика. Свойства?
4. Соли. Характеристика. Примеры. Уравнения реакций?
5.Оксиды. Характеристика Примеры. Уравнения реакций?
6.Осннования. Характеристика? Примеры.Уравнения реакций
| формирование новых знаний
| 30мин
|
| 2. Классификация химических соединений
| Задание № 2
Начертите схему классификация неорганических соединений. Приведите примеры.
| формирование умения решать задачи и отвечать на вопросы
|
мин
|
| 3. Задания на знание кислот и солей
| Название кислоты Формула Пример соли Название соли
Серная
сульфат К
сернистая
сульфит Na
соляная
хлорид Са
иодоводородная
иодид К
сероводородная
cульфид Na
азотная
нитрат К
азотистая нитрит Na
ортофосфорная
хлорная
перхлорат Na
хлорноватая
кремниевая
силикат Сa
| формирование умения находить отличия
|
мин
|
| 4. Вычисление эквивалента элемента
| Задание № 4
Эквивалент элемента равен:  , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении. Эквивалент кислоты равен: , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении. Эквивалент кислоты равен:  , где: М – мольная масса кислоты; х – основность кислоты. Эквивалент основания равен: , где: М – мольная масса кислоты; х – основность кислоты. Эквивалент основания равен:  , где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен: , где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен: 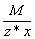 , где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Вычислите эквивалент кислорода, едкого натра угольной кислоты, серной кислоты, соляной кислоты, воды. , где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Вычислите эквивалент кислорода, едкого натра угольной кислоты, серной кислоты, соляной кислоты, воды.
| закрепление знаний, полученных на теоретических занятиях
| 35 мин
|
| 5.Подведение итогов работы
| Сделать вывод о проделанной работе, отметить, что удалось и вызвало трудности. Записать вывод в дневник.
| рефлексия
|
мин
|
| 6. Контроль выполнения работы
| Сдать дневник преподавателю, отчитаться о проделанной работе
| контроль полученных знаний
| 5 мин
|
| 7.Уборка рабочего места
| Убрать рабочее место, сдать раздаточный материал по проведению работы преподавателю.
| организованное завершение работы
| 1мин
|
Методическая разработка для студентов
к практическому занятию № 7
по дисциплине «Фармацевтическая химия»
тема: «Фармацевтический анализ глюкозы»
Цели занятия:
Студент должен знать:
- лекарственных форм, путей введения
лекарственных средств, виды их
действия и взаимодействия;
- основных лекарственных групп и
фармакотерапевтические действия
- побочных эффектов, видов реакций и
осложнений лекарственной терапии;
Студент должен уметь:
- осуществлять все виды контроля качества лекарственных средств в соответствии с нормативной документацией
- - находить сведения о лекарственных
препаратах в доступных базах данных;
- ориентироваться в номенклатуре
лекарственных средств;
- рекомендовать лекарственные средства по
назначению врача;
- давать рекомендации пациенту по
применению различных лекарственных форм;
Оснащение: методические указания по выполнению работы с приложениями
Ориентировочная карта № 1 (задание на самоподготовку)
| № п/п
| Учебные элементы
| Истоки
| Цель деятельности
| Вопросы самоконтроля
|
|
| Фармацевтический анализ углеводов
| конспект лекции
| Знать основные правила титрования растворов
| 1. Что такое углеводы?
2. Дисахариды. Моносахариды. Характеристика?
3. Что такое цветная реакция? примеры?
4. Йодометрический метод определения? характеристика?
5. Метаболизм глюкозы. Формулы?
6. Что такое биотин?
7. Что такое стандартный и концентрированный раствор? Приведите примеры?
|
|
| Задание на знание ЛС, ЛВ, ЛФ
| конспект лекции
| Знать характеристики ЛВ
| Составьте таблицу характеристика глюкозы:
1.Показания к применению глюкозы
2.Фармакологическое действие
3. Способ применения
4. Побочные действия
5. Противопоказания
|
|
| Методы качественного анализа
| конспект лекции
| Знать и различать виды титрования
| Сделайте заключение о качестве глюкозы (ОФС 42 – 0220 – 07 – ГФ 12 изд) по показателю:
- растворимость в спирте, растворах щелочей едких(натр), воде
|
|
| Расчёт способов выражения концентрации растворов
| Конспект лекции
| Знать технику расчётов
| чему равна моляльность раствора, приготовленного из глюкозы массой 9 г и воды объемом 500 мл
чему равна моляльность раствора, приготовленного из глюкозы массой 3 г и воды объемом 300 мл
чему равна моляльность раствора, приготовленного из глюкозы массой 5 г и воды объемом 250мл
чему равна моляльность раствора, приготовленного из глюкозы массой 5 г и воды объемом 120 мл
Моляльность раствора показывает количество (число моль) растворённого вещества в 1 кг растворителя. Моляльную концентрацию (m) выражают в моль/кг. формула: m = n / m(растворителя) Для вычисления моляльности раствора надо знать число килограмм растворителя в растворе. В нашем случае растворитель вода и известен его объём. Зная, что 1 л воды по массе равен 1 кг, имеем массу растворителя 0.5 кг; Зная, что химическое количество (n) вещества равно отношению массы вещества к его молярной массе, и учитывая, что молярная масса глюкозы M(C₆H₁₂O₆) равна 180 г/моль (смотри таблицу Менделеева), получаем: n = m / M = 9 / 180 = 0.05 моль; m(C₆H₁₂O₆) = 0.05 / 0,5 = 0.1 моль/кг. Ответ: Моляльность раствора, приготовленного из глюкозы массой 9 г и воды объёмом 500 мл равна 0.1 моль/кг.
|
|
| Качественная реакция на глюкозу
|
| Знать методику проведения химических реакций
|
Приготовление 5% раствора глюкозы. Методика приготовления.
|
к практическому занятию № 7
по дисциплине «Фармацевтическая химия»
тема: «Фармацевтический анализ глюкозы»
| Название этапа
| Описание деятельности
| Цель деятельности
| время
|
| 1. Фармацевтический анализ углеводов
| Задание № 1.
1. Что такое углеводы?
2. Дисахариды. Моносахариды. Характеристика?
3. Что такое цветная реакция? примеры?
4. Йодометрический метод определения? характеристика?
5. Метаболизм глюкозы. Формулы?
6. Что такое биотин?
7. Что такое стандартный и концентрированный раствор? Приведите примеры?
| формирование новых знаний
| 10мин
|
| 2. Задание на знание ЛС, ЛВ, ЛФ
| Задание № 2
Составьте таблицу характеристика глюкозы:
1.Показания к применению глюкозы
2.Фармакологическое действие
3. Способ применения
4. Побочные действия
5. Противопоказания
| формирование умения решать задачи
|
мин
|
| 3. Методы качественного анализа
| Задание № 3
Сделайте заключение о качестве глюкозы (ОФС 42 – 0220 – 07 – ГФ 12 изд) по показателю:
- растворимость в спирте, растворах щелочей едких (натр), воде
| формирование умения решать задачи
|
мин
|
| 4. Расчёт способов выражения концентрации растворов
| Задание № 4
чему равна моляльность раствора, приготовленного из глюкозы массой 9 г и воды объемом 500 мл
чему равна моляльность раствора, приготовленного из глюкозы массой 3 г и воды объемом 300 мл
чему равна моляльность раствора, приготовленного из глюкозы массой 5 г и воды объемом 250мл
чему равна моляльность раствора, приготовленного из глюкозы массой 5 г и воды объемом 120 мл
| закрепление знаний, полученных на теоретических занятиях
| 30 мин
|
| 5. Качественная реакция на глюкозу
| Приготовление 5% раствора глюкозы. Методика приготовления.
| рефлексия
|
мин
|
| 6. Контроль выполнения работы
| Сдать дневник преподавателю, отчитаться о проделанной работе
| контроль полученных знаний
| 5 мин
|
| 7.Уборка рабочего места
| Убрать рабочее место, сдать методические указания по проведению работы преподавателю
| организованное завершение работы
| 1мин
|
Методическая разработка для студентов
к практическому занятию № 8
по дисциплине «Фармацевтическая химия»
тема: «Фармацевтический анализ стрептоцида -порошка для наружного применения (ФСП 42-0405-3319-02)»
Цели занятия:
Студент должен знать:
- лекарственных форм, путей введения
лекарственных средств, виды их
действия и взаимодействия;
- основных лекарственных групп и
фармакотерапевтические действия
- побочных эффектов, видов реакций и
осложнений лекарственной терапии;
Студент должен уметь:
- осуществлять все виды контроля качества лекарственных средств в соответствии с нормативной документацией
- - находить сведения о лекарственных
препаратах в доступных базах данных;
- ориентироваться в номенклатуре
лекарственных средств;
- рекомендовать лекарственные средства по
назначению врача;
- давать рекомендации пациенту по
применению различных лекарственных форм;
Оснащение: методические указания по выполнению работы с приложениями
Ориентировочная карта № 1 (задание на самоподготовку)
| № п/п
| Учебные элементы
| Истоки
| Цель деятельности
| Вопросы самоконтроля
|
|
| Фармацевтический анализ и его стадии
| конспект лекции
| Знать основные правила титрования растворов
| 1. Стадия производства и контроля ЛС?
2. Сульфаниламидные препараты. Их характеристика.
3. ЛФ- порошки? Характеристика?
4. Органические и неорганические кислоты, примеры описание?
5. Что такое синтез ЛС?
6. Правила работы с мерной посудой?
7. Что такое техническая влага?
|
|
| Задание на знание ЛС, ЛВ, ЛФ
| конспект лекции
| Знать характеристики ЛВ
| Составьте таблицу характеристика стрептоцида:
1.Показания к применению порошка стрептоцида
2.Фармакологическое действие
3. Способ применения
4. Побочные действия
5. Противопоказания
|
|
| Методы качественного анализа в приготовлении растворов
| конспект лекции
| Знать и различать виды титрования
| В стакан теплой кипяченой воды насыпьте измельченный в порошок стрептоцид (1 таблетка на 200 мл воды) и дождитесь полного его растворения. Размешайте жидкость, чтобы действующее вещество равномерно распределилось.
Подумайте и напишите для чего можно использовать приготовленный раствор? Какова концентрация полученного раствора?
|
|
| Синтез ЛС
| Конспект лекции
| Знать технику расчётов
| 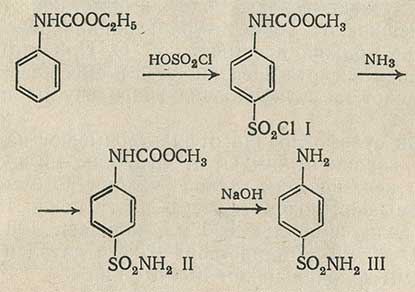 Зарисуйте схему синтеза стрептоцида. Опишите данный процесс постадийно.
Зарисуйте схему синтеза стрептоцида. Опишите данный процесс постадийно.
|
|
| Качественная реакция на содержание порошка
|
| Знать методику проведения химических реакций
| Изучите состав стрептоцида: 1 таблетка содержит сульфаниламида 0,3 или 0,5 г; в упаковке 10 шт. и рассчитайте:
Содержание порошка в граммах вычисляют по формулам:
1.для однокомпонентных порошков:
(п – п0)· Р ·А
X= -----------------, где
F· а· 100
Р – развеска порошка,
А – количество растворителя, взятое для растворения определенной навески порошка
а – масса порошка, взятая для анализа,
F – фактор прироста показателя преломления,
п – показатель преломления раствора,
п0 – показатель преломления растворителя.
2.для двухкомпонентной смеси порошка:
[ п1 – (п0 + c1· F1) ] ·Р· А
X = -------------------------------, где
F · а · 100
с1 – концентрация в % ингредиентов, определяемого химическим методом,
F1 – фактор прироста показателя преломления для этого вещества,
.
|
к практическому занятию № 8
по дисциплине «Фармацевтическая химия»
тема: Фармацевтический анализ стрептоцида -порошка для наружного применения (ФСП 42-0405-3319-02)
| Название этапа
| Описание деятельности
| Цель деятельности
| время
|
| 1. Фармацевтический анализ и его стадии
| Задание № 1.
1. Стадия производства и контроля ЛС?
2. Сульфаниламидные препараты. Их характеристика.
3. ЛФ- порошки? Характеристика?
4. Органические и неорганические кислоты, примеры описание?
5. Что такое синтез ЛС?
6. Правила работы с мерной посудой?
7. Что такое техническая влага?
| формирование новых знаний
| 10мин
|
| 2. Задание на знание ЛС, ЛВ, ЛФ
| Задание № 2
Составьте таблицу характеристика стрептоцида:
1.Показания к применению порошка стрептоцида
2.Фармакологическое действие
3. Способ применения
4. Побочные действия
5. Противопоказания
| формирование умения решать задачи
|
мин
|
| 3. Методы качественного анализа
| Задание № 3
В стакан теплой кипяченой воды насыпьте измельченный в порошок стрептоцид (1 таблетка на 200 мл воды) и дождитесь полного его растворения. Размешайте жидкость, чтобы действующее вещество равномерно распределилось.
Подумайте и напишите для чего можно использовать приготовленный раствор? Какова концентрация полученного раствора?
| формирование умения решать задачи
|
мин
|
| 4. Синтез ЛС
| Задание № 4
 Зарисуйте схему синтеза стрептоцида. Опишите данный процесс постадийно.
Зарисуйте схему синтеза стрептоцида. Опишите данный процесс постадийно.
| закрепление знаний, полученных на теоретических занятиях
| 30 мин
|
| 5. Качественная реакция на содержание порошка
| Изучите состав стрептоцида: 1 таблетка содержит сульфаниламида 0,3 или 0,5 г; в упаковке 10 шт. и рассчитайте:
Содержание порошка в граммах вычисляют по формулам:
1.для однокомпонентных порошков:
(п – п0)· Р ·А
X= -----------------, где
F· а· 100
Р – развеска порошка,
А – количество растворителя, взятое для растворения определенной навески порошка
а – масса порошка, взятая для анализа,
F – фактор прироста показателя преломления,
п – показатель преломления раствора,
| рефлексия
|
мин
|
| 6. Контроль выполнения работы
| Сдать дневник преподавателю, отчитаться о проделанной работе
| контроль полученных знаний
| 5 мин
|
| 7.Уборка рабочего места
| Убрать рабочее место, сдать методические указания по проведению работы преподавателю
| организованное завершение работы
| 1мин
|
Методическая разработка для студентов
к практическому занятию № 6
по дисциплине «Аналитическая химия»
тема: «Анализ смеси катионов 3 аналитической группы»
Цели занятия:
Студент должен знать:
- теоретические основы аналитической химии
- методы качественного и количественного анализа
- качественные реакции, применяемые в фармацевтическом анализе
Студент должен уметь:
- уметь составлять уравнения реакций в молекулярной и сокращенной ионной форме, владеть техникой обычных аналитических операций
- уметь по химическим свойствам веществ, в том числе лекарственных, подбирать методы качественного и количественного анализа
- работать с мерной посудой; на аналитических весах;
- готовить титрованные растворы, устанавливать титр и эквивалентную концентрацию раствора;
- титровать из бюретки, титровальной
установкой, точно фиксировать точку конца титрования
- применять методы количественного анализа при контроле различных исследуемых веществ
- работать с приборами (ФЭК, рефрактометр и др.).
- грамотно оформлять и обрабатывать полученные результаты.
Оснащение: методические указания по выполнению работы с приложениями
Ориентировочная карта № 1 (задание на самоподготовку)
| № п/п
| Учебные элементы
| Истоки
| Цель деятельности
| Вопросы самоконтроля
|
|
| Классификация по аналитическим группам.
| конспект лекции
| Знать основные классификации катионов.
| 1. Перечислите катионы относящиеся к 3 аналитической группе?
2. Что такое химическая реакция. Типы химических реакций?
3. Качественные реакции катионов 3 аналитической группы?
4. Общие и частые реакции катионов 3 аналитической группы?
5. Виды средней пробы?
6. Что такое навеска вещества?
7.Что такое групповой реагент для катионов 3 группы?
|
|
| Этапы хим. анализа. Общие правила работы с хим. реагентами
| конспект лекции
| Знать этапы выполнения хим. анализа
| ЭТАПЫ ХИМИЧЕСКОГО АНАЛИЗА.
а.Отбирают среднюю /генеральную пробу/.
б.Измельчают, перемешивают и отбирают лабораторную пробу. Её делят на несколько частей, из них 1-2 оставляют для контроля, с остальными работают.
Они называются аналитическими пробами.
в. Делят исследуемое вещество на составные части: растворяют в соответствующих растворителях / кислотах, орг. веществах, воде / и осаждают часть веществ, экстрагируют и др.
г. Подбирают соответствующую аналитическую реакцию
д. Проводят расчеты.
|
|
| Проведение хим. анализа
| конспект лекции
| Знать методику проведения хим. анализа
| РЕАКТИВЫ: соли Сa2+, Ba2+. Растворы H2SO4 KMnO4 Н2О2 K2Cr2O7, ацетат натрия, р-р. HCl.
ОБОРУДОВАНИЕ: Спиртовка, нихромовая проволока, микроскоп, предметные стекла, пипетки, пробирки.
ХОД РАБОТЫ.
1. Исследовать соли в пламени спиртовки. записать результат в рабочие журнал.
2. Добавить к растворам CaCl2 и BaCl2 несколько капель H2SO4. Отметить результат. Записать уравнение реакции.
3. Провести осаждение солеи Са2+ и Вa2+ раствором бихромата калия. Отметить внешний вид осадков. Зарисовать кристаллы в рабочем журнале. Отобрать пробу осадков; к каждому добавить несколько капель раствора ацетата натрия. Отметить происходящие изменение. Написать уравнение реакции в молекулярном и ионном виде.
4. Провести осаждение сульфатов кальция и бария в присутствии KMnO4 Отметить цвета образующихся осадков. Добавить несколько капель Н2О2. Отметить происходящие изменения. Написать уравнение реакций.
Сделать вывод об общем реагенте.
|
|
| Уравнения химический реакций
| конспект лекции
| Знать классификацию аналитических групп, групповые реагенты и хим. реакции
| Написать качественные химические реакции на катионы 3 аналитической группы.
|
|
| Кристаллы катионов
|
| Знать конфигурацию кристаллов
|
|

 , где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении. Эквивалент кислоты равен:
, где: М – мольная масса элемента; СО – степень окисления элемента (валентность) в соединении. Эквивалент кислоты равен:  , где: М – мольная масса кислоты; х – основность кислоты. Эквивалент основания равен:
, где: М – мольная масса кислоты; х – основность кислоты. Эквивалент основания равен:  , где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен:
, где: М – мольная масса основания; у – кислотность основания.
Эквивалент соли равен: 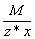 , где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Вычислите эквивалент кислорода, едкого натра угольной кислоты, серной кислоты, соляной кислоты, воды.
, где: М – мольная масса соли; z – валентность катиона; х – количество атомов катиона в соединении.
Вычислите эквивалент кислорода, едкого натра угольной кислоты, серной кислоты, соляной кислоты, воды.
 Зарисуйте схему синтеза стрептоцида. Опишите данный процесс постадийно.
Зарисуйте схему синтеза стрептоцида. Опишите данный процесс постадийно.



