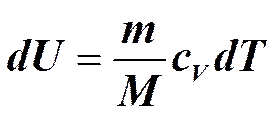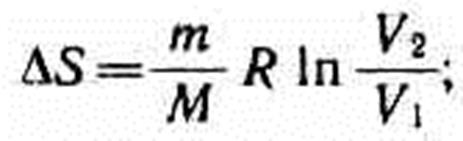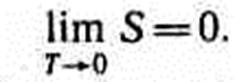Энтропия, ее статистическое толкование и связь с термодинамической вероятностью.
Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов). Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
Так как.
при изотермическом процессе (T1=T2)
при изохорном процессе (V 1 =V 2 )
Согласно Больцману энтропия S системы и термодинамическая вероятность связаны между собой следующим образом: S = k lnW где k — постоянная Больцмана.
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов.
Краткая формулировка второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. две формулировки второго начала термодинамики: 1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу; 2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому. Первые два начала термодинамики дают недостаточно сведений о поведении термодинамических систем при нуле Кельвина. Они дополняются третьим началом термодинамики, или теоремой Нернста — Планка: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина:
|