Атомы и молекулы. Молекулярная масса. Закон Авогадро
Если не считать умозрительных наивных атомистических систем древних, современные представления о молекулах и атомах зародились в исследованиях химиков. Они в свое время обратили внимание на то, что в химических реакциях, в которых реагенты взаимодействуют без остатка, их массы находятся в кратных некоторым числам отношениях. Эти наблюдения подтолкнули исследователей к догадке, что вещества в химических реакциях взаимодействуют некоторыми малыми неделимыми порциями с массой, характерной для данного вещества. Наименьшую порцию вещества, сохраняющую его химические свойства, назвали молекулой. Задача 1. Азот может образовывать с кислородом пять различных соединений. Так, 7 г азота, соединяясь без остатка с: Решение. Представления об атомах и молекулах в действии. б) Предположим, что молекула соединения содержит x атомов азота и y атомов кислорода. Пусть mxy - масса молекулы закиси азота, mx - масса молекулы азота, my - масса молекулы кислорода, Mxy - масса соединения, Mx - масса азота, входящего в соединение, My - масса кислорода, входящего в соединение. Число молекул соединения, содержащегося в массе Mxy, равно Mxy/mxy. Из определения чисел х и y следует, что Условия задачи и проведенные рассуждения дают отношение y/x, поэтому данные задачи позволяют определить химическую формулу со стехиометрическими показателями с точностью до постоянного множителя. Возможные химические формулы: закись азота - N2O или N4O2,или...; окись азота - NO или N2O2, или...; азотистый ангидрид - N2O3 или N4O6,или...; двуокись азота NO2, или N2O4,или...; азотный ангидрид - N2O5, или N4O10,или.... в) В предположении о безграничной делимости вещества элементы могли бы соединяться в любых весовых отношениях, поэтому соединений азота с кислородом должно было бы быть бесконечное множество. Предположение о безграничной делимости не позволяет объяснить конечность числа возможных соединений азота и кислорода. Из молекулярных представлений следует, что если брать порции некоторого наперед заданного числа молекул, то отношения масс порций разных веществ будет равно отношению масс молекул. Количество вещества, масса которого составляет число граммов, равное молекулярному весу этого вещества, называется граммолекулой или молем. Число молекул в моле равно числу Авогадро No=6.025×1023 моль-1. [Число молекул, содержащихся в одном моле вещества (число Авогадро) впервые определил Жан Перрен при изучении распределения по высоте плотности броуновских частиц в жидкости. Идея опытов Перрена будет обсуждена позднее при изучении распределения Больцмана.]
Решение. Данные для задачи берутся из эксперимента. Нужны градуированная бюретка и магниевая лента или кусочек магния. Масса ленты тщательно взвешивается. В пробирку наливается соляная кислота HCl (заведомо с избытком). Пробирка удерживается в наклонном положении и к стенке прилепляется кусочек магниевой ленты. Он не соскальзывает в кислоту с мокрой стенки. Пробирка заткнута резиновой пробкой с трубкой, которая соединена с нижним концом бюретки. Кусочек магниевой ленты стряхивается со стенки пробирки, либо пробирку наклоняют так, чтобы кислота залила кусочек. Объем получившегося водорода измеряют по подъему уровня воды в бюретке. Количество используемого в реакции магния подбирают так, чтобы образовавшийся водород не вытеснил воду из бюретки до выливания. а) Число молей магния n найдется по определению б) Из реакции видно, что из каждого моля магния получается моль водорода, поэтому число молей получившегося водорода равно числу молей участвовавшего в реакции магния. в) Занимаемый объем водорода пропорционален числу молей водорода nH. Имеем: V=V0×nH, где V - объем получившегося водорода, V0 - объем одного моля водорода. Таким образом, находим Закон Авогадро говорит о том, что равные количества газообразного вещества, выраженные в молях, занимают равные объемы при одинаковых температурах и одинаковых давлениях, или - в равных объемах газов при одинаковых условиях содержится равное число молекул. При 0oС и давлении 760 мм рт. ст. один моль газа занимает 22,4 л. Получающееся из проведенного эксперимента значение объема, занимаемого одним молем водорода, превышает 22,4 л, так как эксперимент проводится при комнатной температуре и при пониженном давлении (по сравнению с давлением на уровне моря).
|

 (1)
(1)  (2)
(2) для окиси азота
для окиси азота  для азотистого ангидрида
для азотистого ангидрида 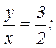 для двуокиси азота
для двуокиси азота  для азотного ангидрида
для азотного ангидрида 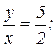 .
.
 Задача 2 [ экспериментальная ]. Проводится реакция соединения некоторой массы M магния (Mg) с соляной кислотой. При этом выделяется водород, который собирается в мерную бюретку.
Задача 2 [ экспериментальная ]. Проводится реакция соединения некоторой массы M магния (Mg) с соляной кислотой. При этом выделяется водород, который собирается в мерную бюретку.  (3)
(3)  .
.


