Межмолекулярное взаимодействие приводит также к новым, экспериментально наблюдаемым явлениям. Одно из них – эффект Джоуля-Томсона. Он заключается в повышении или понижении температуры газа при продавливании его сквозь пористую перегородку.

 В газе молекулы большую часть времени находятся на больших расстояниях друг от друга, поэтому чаще всего добавка потенциальной энергии взаимодействия полной внутренней энергии газа мала по сравнению с полной внутренней энергией. Тем не менее – в явлении (или эффекте) Джоуля-Томсона межмолекулярное взаимодействие является определяющим. Экспериментальная установка представляет собой следующее. В хорошо теплоизолированной трубе газ продавливается через пористую перегородку. Отверстия и каналы в перегородке имеют поперечные размеры меньшие длины свободного пробега молекул, так что явления гидродинамического разгона одних молекул другими не происходит. Перегородка создает сопротивление протеканию газа. Так что давление газа, прошедшего перегородку, меньше начального давления. Соответственно газ за перегородкой оказывается расширенным. Адиабатическое расширение газа при его перетекании из одного сосуда в другой называется дросселированием. Выделим объем газа перед перегородкой V1. При его продавливании внешнее устройство совершает над данной порцией газа работу, равную F1L1=P1V1 (L1 – толщина слоя).Выделенная порция за перегородкой отодвигает имевшийся там ранее газ на расстояние L2. При этом совершается работа F2L2=P2V2. Поскольку процесс расширения происходит в условиях тепловой изоляции, полная работа равна изменению внутренней энергии.
В газе молекулы большую часть времени находятся на больших расстояниях друг от друга, поэтому чаще всего добавка потенциальной энергии взаимодействия полной внутренней энергии газа мала по сравнению с полной внутренней энергией. Тем не менее – в явлении (или эффекте) Джоуля-Томсона межмолекулярное взаимодействие является определяющим. Экспериментальная установка представляет собой следующее. В хорошо теплоизолированной трубе газ продавливается через пористую перегородку. Отверстия и каналы в перегородке имеют поперечные размеры меньшие длины свободного пробега молекул, так что явления гидродинамического разгона одних молекул другими не происходит. Перегородка создает сопротивление протеканию газа. Так что давление газа, прошедшего перегородку, меньше начального давления. Соответственно газ за перегородкой оказывается расширенным. Адиабатическое расширение газа при его перетекании из одного сосуда в другой называется дросселированием. Выделим объем газа перед перегородкой V1. При его продавливании внешнее устройство совершает над данной порцией газа работу, равную F1L1=P1V1 (L1 – толщина слоя).Выделенная порция за перегородкой отодвигает имевшийся там ранее газ на расстояние L2. При этом совершается работа F2L2=P2V2. Поскольку процесс расширения происходит в условиях тепловой изоляции, полная работа равна изменению внутренней энергии.
 P1V1-P2V2=U2-U1 Þ U1+P1V1=U2+P2V2. (1)
P1V1-P2V2=U2-U1 Þ U1+P1V1=U2+P2V2. (1)
Величина U+PV - энтальпия выделенной порции газа. Уравнение (1) говорит, что в описанном процессе энтальпия газа остается постоянной. Если газ является идеальным, единственным эффектом при продавливании порции газа является увеличение расстояния между молекулами, поэтому P1V1=P2V2, и U1=U2 – температура газа должна оставаться неизменной. В опыте обнаруживается, что при не слишком высоких значениях P1 (и P2), температура азота, кислорода, углекислого газа и ряда других за перегородкой оказывается ниже, чем перед перегородкой. Объяснение состоит в следующем. За перегородкой среднее расстояние между молекулами больше, чем перед перегородкой, значит среднее значение потенциальной энергии молекул становится большим (ближе к нулю). А так как при просачивании кроме совершенной работы газ не получал энергии извне увеличение потенциальной энергии идет за счет уменьшения кинетической энергии молекул, то есть за счет понижения температуры.
Если давление газа перед перегородкой столь велико, что потенциальная энергия взаимодействия молекул чаще оказывается положительной, то после просачивания газа сквозь перегородку из-за увеличения среднего расстояния между молекулами потенциальная энергия взаимодействия уменьшается. Освободившаяся потенциальная энергия идет на возрастание кинетической энергии молекул, то есть на увеличение температуры.
Количественно эффект Джоуля-Томсона характеризуется дифференциальным коэффициентом Джоуля-Томсона m, который определяет отношение перепада температуры DT к перепаду давлений DP
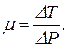 (2)
(2)


 В газе молекулы большую часть времени находятся на больших расстояниях друг от друга, поэтому чаще всего добавка потенциальной энергии взаимодействия полной внутренней энергии газа мала по сравнению с полной внутренней энергией. Тем не менее – в явлении (или эффекте) Джоуля-Томсона межмолекулярное взаимодействие является определяющим. Экспериментальная установка представляет собой следующее. В хорошо теплоизолированной трубе газ продавливается через пористую перегородку. Отверстия и каналы в перегородке имеют поперечные размеры меньшие длины свободного пробега молекул, так что явления гидродинамического разгона одних молекул другими не происходит. Перегородка создает сопротивление протеканию газа. Так что давление газа, прошедшего перегородку, меньше начального давления. Соответственно газ за перегородкой оказывается расширенным. Адиабатическое расширение газа при его перетекании из одного сосуда в другой называется дросселированием. Выделим объем газа перед перегородкой V1. При его продавливании внешнее устройство совершает над данной порцией газа работу, равную F1L1=P1V1 (L1 – толщина слоя).Выделенная порция за перегородкой отодвигает имевшийся там ранее газ на расстояние L2. При этом совершается работа F2L2=P2V2. Поскольку процесс расширения происходит в условиях тепловой изоляции, полная работа равна изменению внутренней энергии.
В газе молекулы большую часть времени находятся на больших расстояниях друг от друга, поэтому чаще всего добавка потенциальной энергии взаимодействия полной внутренней энергии газа мала по сравнению с полной внутренней энергией. Тем не менее – в явлении (или эффекте) Джоуля-Томсона межмолекулярное взаимодействие является определяющим. Экспериментальная установка представляет собой следующее. В хорошо теплоизолированной трубе газ продавливается через пористую перегородку. Отверстия и каналы в перегородке имеют поперечные размеры меньшие длины свободного пробега молекул, так что явления гидродинамического разгона одних молекул другими не происходит. Перегородка создает сопротивление протеканию газа. Так что давление газа, прошедшего перегородку, меньше начального давления. Соответственно газ за перегородкой оказывается расширенным. Адиабатическое расширение газа при его перетекании из одного сосуда в другой называется дросселированием. Выделим объем газа перед перегородкой V1. При его продавливании внешнее устройство совершает над данной порцией газа работу, равную F1L1=P1V1 (L1 – толщина слоя).Выделенная порция за перегородкой отодвигает имевшийся там ранее газ на расстояние L2. При этом совершается работа F2L2=P2V2. Поскольку процесс расширения происходит в условиях тепловой изоляции, полная работа равна изменению внутренней энергии. P1V1-P2V2=U2-U1 Þ U1+P1V1=U2+P2V2. (1)
P1V1-P2V2=U2-U1 Þ U1+P1V1=U2+P2V2. (1) 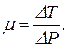 (2)
(2)


