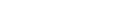
 Рассмотрим две изотермы для одного моля азота. Одна изотерма, соответствует температуре 100°К, а другая – 200°К. Обратите внимание, что при 0°С при атмосферном давлении данное количество газа занимало бы объем более 20 л. Один литр и менее соответствует довольно значительному сжатию одного моля. Однако, как следует из таблицы, отклонение газа от закона Р~Т при объеме 1 л не слишком значительно. По мере дальнейшего сжатия отклонение возрастает. В области значений объема 0,1 – 0,2 л на низкотемпературной изотерме наблюдается складка. Между состояниями А и В с уменьшением объема уменьшается и давление. Уравнение состояния перестает описывать реальность. Среда, обладающая такими свойствами, не может оставаться однородной.
Рассмотрим две изотермы для одного моля азота. Одна изотерма, соответствует температуре 100°К, а другая – 200°К. Обратите внимание, что при 0°С при атмосферном давлении данное количество газа занимало бы объем более 20 л. Один литр и менее соответствует довольно значительному сжатию одного моля. Однако, как следует из таблицы, отклонение газа от закона Р~Т при объеме 1 л не слишком значительно. По мере дальнейшего сжатия отклонение возрастает. В области значений объема 0,1 – 0,2 л на низкотемпературной изотерме наблюдается складка. Между состояниями А и В с уменьшением объема уменьшается и давление. Уравнение состояния перестает описывать реальность. Среда, обладающая такими свойствами, не может оставаться однородной.
Рассмотрим состояние газа на участке АВ. Предположим, что газ может находиться в однородном состоянии на этом участке. Разобьем объем первоначально однородного газа на две части. В результате тепловых флуктуаций могут происходить случайные колебания плотности. При этом как угодно малое расширение одной из частей происходит за счет сжатия другой. Так как давление в сжатой части при этом уменьшится, а давление в расширенной – увеличится, процесс сжатия одной части и расширения другой будет далее самопроизвольно продолжаться. Газ расслоится на части, отличающиеся друг от друга плотностями. Это ничто иное, как конденсация – выпадение жидкой фазы
При высоких температурах на изотерме исчезают складки. Наименьшая температура, при которой на изотерме исчезает складка, называется критической Ткр.. При T>Tкр. расслоение невозможно, газ всегда остается газом. При T<Tкр. при определенной плотности происходит расслоение. Газ превращается в жидкость или, при очень низких температурах, в твердое тело. Теория Ван-дер-Ваальса дает объяснение конденсации. Каждая однородная часть называется фазой. В области между точками А и В сосуществуют две фазы. Они находятся в тепловом равновесии. Число молекул покидающих и возвращающихся в фазу в единицу времени равны.

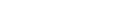
 Рассмотрим две изотермы для одного моля азота. Одна изотерма, соответствует температуре 100°К, а другая – 200°К. Обратите внимание, что при 0°С при атмосферном давлении данное количество газа занимало бы объем более 20 л. Один литр и менее соответствует довольно значительному сжатию одного моля. Однако, как следует из таблицы, отклонение газа от закона Р~Т при объеме 1 л не слишком значительно. По мере дальнейшего сжатия отклонение возрастает. В области значений объема 0,1 – 0,2 л на низкотемпературной изотерме наблюдается складка. Между состояниями А и В с уменьшением объема уменьшается и давление. Уравнение состояния перестает описывать реальность. Среда, обладающая такими свойствами, не может оставаться однородной.
Рассмотрим две изотермы для одного моля азота. Одна изотерма, соответствует температуре 100°К, а другая – 200°К. Обратите внимание, что при 0°С при атмосферном давлении данное количество газа занимало бы объем более 20 л. Один литр и менее соответствует довольно значительному сжатию одного моля. Однако, как следует из таблицы, отклонение газа от закона Р~Т при объеме 1 л не слишком значительно. По мере дальнейшего сжатия отклонение возрастает. В области значений объема 0,1 – 0,2 л на низкотемпературной изотерме наблюдается складка. Между состояниями А и В с уменьшением объема уменьшается и давление. Уравнение состояния перестает описывать реальность. Среда, обладающая такими свойствами, не может оставаться однородной.


