Существует функция состояния термодинамической системы – энтропия. При обратимых процессах в изолированной системе ее энтропия не изменяется, а при необратимых – увеличивается.
В ходе самопроизвольного процесса энтропия изолированной системы должна возрастать, достигая максимального значения при равновесии. Выясним количественную меру энтропии:
или в интегральном виде:
Выражения (II,1) и (II, 1а) являются определениями функции S, которая называется энтропией. Энтропия является однозначной, непрерывной и конечной функцией состояния. Энтропия измеряется в тех же единицах, что и теплоемкость, т. е. в джоулях на моль на кельвин ( Как указывалось выше, элементарная теплота не является в общем случае дифференциалом функции. Из уравнения (II, 1) следует, что dQ после деления на Т становится дифференциалом функции, т. е. с математической точки зрения, 1/Т является для теплоты интегрирующим множителем (или Т – интегрирующим делителем). Исследуя энтропию, очевидно, можно предсказывать направление процесса. Если в изолированной системе для какого-либо процесса энтропия возрастает, то процесс возможен (может протекать самопроизвольно); если энтропия изолированной системы согласно расчету должна убывать, то процесс невозможен (отрицателен). При постоянстве энтропии – процесс равновесен, система бесконечно близка к равновесию. Обобщая сказанное, можно записать следующее выражение:
Следует подчеркнуть, что в системе, обменивающейся теплотой и работой с окружающей средой, возможны процессы, сопровождающиеся как возрастанием, так и убылью энтропии системы. Поэтому для однозначного решения вопроса о направлении процесса следует включить в систему все тела, участвующие в процессе, и таким образом сделать систему изолированной.
|


 dS (II, 1)
dS (II, 1)
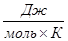 ).
). (II, 2)
(II, 2)


