Идеальный газ. Уравнение состояния идеального газа. Закон Авогадро. Смеси идеальный газов. Теплоемкость идеальных газов и их смесей. Первый закон термодинамики.
Этот пропагандистский прием активно использует возможности психологического влияния за счет структуризации текста. Всегда предпочтительнее не лгать, а добиться, чтобы человек не заметил «ненужной» правды Коммуникатор дает позитивное сообщение между негативным предисловием и негативным заключением. При наличии определенных способностей и опыта коммуникатора, положительное сообщение как бы исчезает от внимания аудитории. Очень хороший прием, активно используемый теми СМИ, которые претендуют на «объективное освещение событий» и стремятся создать себе имидж в стиле «только факты, ничего кроме фактов». При таком структурировании событий объективность формально соблюдена, но эффект «ненужных» сообщений девальвирован. Обратным к предыдущему является т.н. «Сахарный сэндвич». Негативное сообщение маскируется положительным вступлением и положительным заключением.
Теплота и работа Тела, участвующие в процессе, обмениваются между собой энергией. Энергия одних тел увеличивается, других - уменьшается. Передача энергии от одного тела к другому происходит 2-мя способами:
Идеальный газ. Уравнение состояния идеального газа. Закон Авогадро. Смеси идеальный газов. Теплоемкость идеальных газов и их смесей. Первый закон термодинамики. Уравнение состояния идеального газа (уравнение Менделеева —Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где · · · · Так как
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона. Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную
Менделеев же обнаружил, что Закон Авогадро — В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Следствие 1: Один моль любого газа при одинаковых условиях занимает одинаковый объем В частности, при нормальных условиях (T=0 °C (273К) и p=101,3 кПа) объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона
Из Уравнения Менделеева-Клапейрона выводятся еще 3 закона 1) Закон Шарля: 2) Закон Гей-Люссака: 3) Закон Боля-Мариотта: Следствие 2: Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов Эта постоянная величина называется относительной плотностью газов и обозначается D. Так как молярные объемы всех газов одинаковы (1-е следствие закона Авогадро), то отношение молярных масс любой пары газов также равна этой постоянной:
В Формуле мы использовали:
|

 ,
, — давление,
— давление, — молярный объём,
— молярный объём, — универсальная газовая постоянная
— универсальная газовая постоянная — абсолютная температура, К.
— абсолютная температура, К. , где
, где  — количество вещества, а
— количество вещества, а  , где
, где  — масса,
— масса, 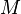 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
 , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:



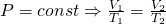


 — Относительная плотность газа
— Относительная плотность газа — Молярные массы
— Молярные массы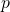 — Давление
— Давление — Молярный объем
— Молярный объем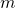 — Масса
— Масса — Универсальная газовая постоянная
— Универсальная газовая постоянная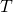 — Абсолютная температу
— Абсолютная температу


