Уравнение Клапейрона-Менделеева
Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных. Для этого используют уравнение состояния идеального газа (его также называют уравнением Клапейрона-Менделеева): PV = n RT где n – число молей газа; P – давление газа (например, в атм; V – объем газа (в литрах); T – температура газа (в кельвинах); R – газовая постоянная (0,0821 л· атм /моль·K). ЗАДАЧА №1 Например, в колбе объемом 2,6 л находится кислород при давлении 2,3 атм и температуре 26 оС. Вопрос: сколько молей O2 содержится в колбе? Из газового закона найдем искомое число молей n:
Не следует забывать преобразовывать температуру из градусов Цельсия в кельвины: (273 оС + 26 оС) = 299 K. Вообще говоря, чтобы не ошибиться в подобных вычислениях, нужно внимательно следить за размерностью величин, подставляемых в уравнение Клапейрона-Менделеева. Если давление дается в мм ртутного столба, то нужно перевести его в атмосферы, исходя из соотношения: 1 атм = 760 мм рт. ст. Давление, заданное в паскалях (Па), также можно перевести в атмосферы, исходя из того, что 101325 Па = 1 атм.
ЗАДАЧА №2. некоторое количество газа гелия при 78 оС и давлении 45,6 атм занимает объем 16,5 л. Каков объем этого газа при нормальных условиях? Сколько это молей гелия? Можно, конечно, просто подставить данные нам значения в уравнение Клапейрона-Менделеева и сразу вычислить число молей n. Но что делать, если на экзамене вы забыли точное значение газовой постоянной R? Газовую постоянную не нужно запоминать – ее можно легко вычислить в любой момент. Действительно, 1 моль газа при нормальных условиях (1 атм и 273 К) занимает объем 22,4 л. Тогда:
Другой способ заключается в том, чтобы заставить газовую постоянную R сократиться. Снова вспомним, что нормальные условия – это давление 1 атм и температура 0 оС (273 K). Запишем все, что нам известно про исходные (в задаче) и конечные (при н.у.) значения P, V и T для нашего газа: Исходные значения: P1 = 45,6 атм, V1 = 16,5 л, T1 = 351 K; Конечные значения: P2 = 1 атм, V2 =? T2 = 273 K. Очевидно, что уравнение Клапейрона-Менделеева одинаково справедливо как для начального состояния газа, так и для конечного: P1V1 = n RT1 P2V2 = n RT2 Если теперь почленно разделить верхнее уравнение на нижнее, то при неизменном числе молей n мы получаем:
После подстановки всех известных нам значений получим объем газа при н.у. V2 = 45,6·16,5·273 / 351 = 585 л Итак, объем гелия при н.у. составит 585 л. Поделив это число на молярный объем газа при н.у. (22,4 л/моль) найдем число молей гелия: 585/22,4 = 26,1 моль.
10. Закон Бойля-Мариотта. Закон Бойля — Мариотта - закон, связывающий изменения объема газа при постоянной температуре с изменениями его упругости. Один из основных газовых законов, согласно которому при постоянной температуре объём V данной массы идеального газа обратно пропорционален его давлению р, т. е. pV = C = const Постоянная С пропорциональна массе газа (числу молей) и его абсолютной температуре. Закон установлен по опытным данным английским учёным Р. Бойлем(1662) и независимо от него французским учёным Э. Мариоттом(1676). Б.—М. з. следует из кинетической теории газов, если принять, что размеры молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует Межмолекулярное взаимодействие. Иными словами, Б.—М. з. выполняется строго для Идеального газа. Для реальных газов, у которых влиянием размеров молекул и их взаимодействием пренебрегать нельзя, Б.—М. з. выполняется приближённо (рис. 2), тем лучше, чем дальше от критического состояния находится газ. 11.Закон Гей-Люссака Закон Гей-Люссака — закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении, названный в честь французского физика и химика Жозефа Луи Гей-Люссака, впервые опубликовавшего его в 1802 году. Изобарический закон, открытый Гей-Люссаком в 1802 году утверждает, что при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Математически закон выражается следующим образом:
или
где Если известно состояние газа при неизменном давлении и двух разных температурах, закон может быть записан в следующей форме:
или
12. Закон Шарля
ЗАКОН ШАРЛЯ, объем газа при постоянном давлении прямо пропорционален его абсолютной температуре. Эта зависимость была впервые выведена Жаком ШАРЛЕМ в 1787 г. Закон представляет собой частный случай ЗАКОНА ИДЕАЛЬНОГО ГАЗА. если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
или
где: P — Давление газа, T — температура газа (в градусах Кельвина), k — константа. Этот закон справедлив, поскольку температура является мерой средней кинетической энергии вещества. Если кинетическая энергия газа увеличивается, его частицы сталкиваются со стенками сосуда быстрее, тем самым создавая более высокое давление. Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:
|






 — объём газа,
— объём газа,  — температура.
— температура.
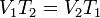 .
.





