Известно, что любое вещество состоит из атомов, химические процессы протекают благодаря взаимодействию атомов. Из практических соображений было введено понятие моля. Условились считать, что 1 моль вещества содержит 6,02×1023 частиц. Любых – атомов, молекул, ионов. Значение 6,02×1023 называется числом Авогадро. Математически понятие моля можно записать в виде формулы:
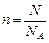 , ,
| (21)
|
где n – количество вещества, моль, N – число частиц (молекул, атомов, ионов), N A – число Авогадро.
Массу 1 моль вещества называют молярной массой M (г/моль). Молярная масса в неорганической химии является характеристикой вещества, непосредственно связанной с его количественным составом и численно равна молекулярной массе (массе 1 молекулы) вещества, выраженной в углеродных единицах. Молярную массу любого вещества можно вычислить по формуле:
 , ,
| (22)
|
где n i – стехиометрической индекс в формуле вещества, Мi – молярная масса элемента, входящего в соединение, г/моль – см. таблицу элементов Д.И. Менделеева.
Связь массы и количества вещества определяется формулой
 . .
| (23)
|
Молярная масса вещества может быть определена экспериментально. Для газов ее находят, например, по относительной плотности газа D, которая представляет собой соотношение молярных масс двух газов, один из которых обычно известен:
 . .
| (24)
|
Наиболее часто используют плотность газа по воздуху D возд., тогда М 2 = М возд. D возд. (М возд.= 29 г/моль), или водороду  , тогда М 2 =
, тогда М 2 =  .
.

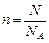 ,
,
 ,
,
 .
.
 .
.
 , тогда М 2 =
, тогда М 2 =  .
.


