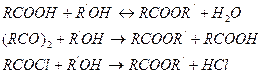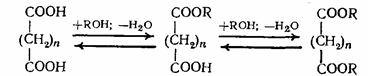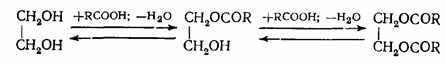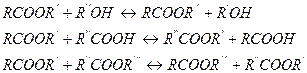Теоретические основы
Процессы этерификации, гидролиза, гидратации и дегидратации в промышленности основного органического и нефтехимического синтеза находят широкое применение для производства одноатомных и многоатомных спиртов, простых и сложных эфиров, одноосновных и многоосновных карбоновых кислот, ангидридов кислот, ненасыщенных соединений, фенолов, σ-оксидов и многих других ценных веществ. Кроме того, эти процессы часто являются промежуточными этапами в многостадийных синтезах других важных соединений. Сложные эфиры применяют в качестве растворителей, пластификаторов, в производстве синтетических смазочных масел, гидравлических жидкостей, поверхностно-активных веществ, в парфюмерии и т. д. Сложные эфиры образуются в результате взаимодействия спиртов с карбоновыми кислотами, ангидридами и хлорангидридами карбоновых кислот:
Если в этерификации участвует двухосновная кислота, то в зависимости от мольного соотношения спирта и кислоты может образоваться продукт как неполной, так и полной этерификации:
Полные и неполные эфиры образуются и тогда, когда взаимодействуют многоатомные спирты и одноосновные кислоты. Выход полных и неполных эфиров и в этом случае зависит от исходного мольного соотношения реагентов:
Если же кислоты и спирты содержат две и более функциональных групп, процесс протекает с образованием полиэфиров линейной или пространственной структуры. Подавляющее большинство реакций этерификации являются равновесными, причем обратная реакция представляет собой гидролиз сложных эфиров. К классу этерификации относят и реакции алкоголиза, ацидолиза, переэтерификации, которые также равновесны:
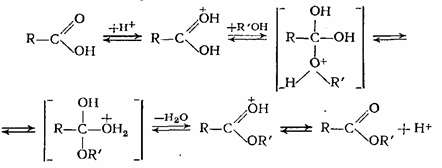
Все перечисленные реакции хорошо катализируются сильными кислотами (например, H2SO4, HC1) и только в случае алкоголиза сложных эфиров более эффективными катализаторами являются3 вещества основного характера (алкоголяты, щелочи и др.). Спирты с карбоновыми кислотами взаимодействуют практически без выделения или поглощения тепла, и поэтому константа равновесия этих реакций мало зависит от температуры. На константу равновесия влияет как строение спирта, так и строение кислоты. Существует несколько способов для смещения равновесия в сторону образования эфира. В жидкофазных процессах этерификации высокой степени конверсии исходных реагентов достигают при отгонке из реакционной массы воды или эфира, а если это невозможно, то повышают концентрацию одного из исходных компонентов. Последний способ применяют и в процессах газофазной этерификации. Механизм реакции этерификации в присутствии протонодонорных кислот можно представить следующей схемой:
В этой системе равновесных превращений самой медленной является реакция спирта с протонированной кислотой, а в обратном направлении (при гидролизе или алкоголизе) реакция воды с протонированным эфиром. Этерификация н -бутилового (пентилового) спирта уксусной кислотой
|