Простые вещества-неметаллы. Строение. Физические свойства
В простых веществах атомы неметаллов связаны ковалентной неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Ки, Вг2), двойные (например, в молекулах серы тронные (например, в молекулах азота ковалентные связи. Как вам уже известно, простые вещества-неметаллы могут иметь: 1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы или твердые вещества и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярного взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке. 2. Атомное строение. Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ко-валентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала. (На рисунке 47 подчеркнуты символы тех элементов-неметаллов, которые образуют только атомные кристаллические решетки.) Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул, и с разным строением кристаллов. Аллотропными модификациями углерода являются а) графит, б) алмаз, в) фуллерен
Элементы-неметаллы, обладающие свойством аллотропии, обозначены на рисунке 47 звездочкой. Так что простых веществ-неметаллов гораздо больше, чем химических элементов- неметаллов. Вы знаете, что дли большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ-неметаллов гамма цветов значительно разнообразнее. Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы - диэлектрики, так как все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая дефор-мация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска. Химические свойства Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства. Окислительные свойства простых веществ неметаллов 1. Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами (как вы знаете, металлы всегда восстановители):
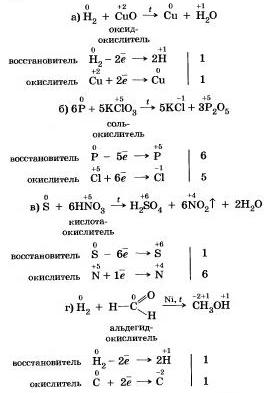
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения. 3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности: Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства. Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя. Фтор самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства. 4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами. Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами -неорганическими и органическими. Восстановительные свойства простых веществ — неметаллов При рассмотрении реакции неметаллов друг с другом мы уже отмечали, что в зависимости от значений их электроотрицательности одни из них проявляет свойства окислителя, а другой — свойства восстановителя. 1. По отношению к фтору все неметаллы (даже кислород) проявляют восстановительные свойства. 2. Разумеется, неметаллы, кроме фтора, служит восстановителями при взаимодействии с кислородом:
8 Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами окислителями:
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, восстановителем, это реакции самоокисления-самовосстановления. Итак, подведем итоги! Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи одному только фтору). 1. К каким электронным семействам откосят элементы-неметаллы? 2. Какие элементы-неметаллы являются биогенными? 3. Какие факторы определяют валентные возможности атомов неметаллов? Рассмотрите их на примере атомов кислорода и серы. 4. Почему одни неметаллы при обычных условиях — газы, другие - твердые тугоплавкие вещества? Приведите примеры простых веществ-неметаллов, существующих при обычных условиях в разном агрегатном состоянии: а) газообразном, б) жидком, в) твердом. 5. Применяемая в медицине йодная настойка является 51% раствором кристаллического йода в этиловом спирте. Какой объем спирта, плотность которого 0.8 г/мл, требуется для приготовления 250 г такого раствора? Ответ: 297 мл.
Оглавление
|