Изменение энтропии 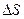 рассчитывается по формуле Клаузиуса:
рассчитывается по формуле Клаузиуса:
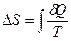 (1)
(1)
где 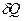 - количество тепла,
- количество тепла, 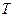 - температура.
- температура.
Для металлического тела, которое охлаждается в воде калориметра 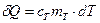 , где
, где 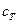 - удельная теплоемкость тела,
- удельная теплоемкость тела,  - масса тела. Подставим это выражение в (1) и найдем изменение энтропии тела в результате теплообмена:
- масса тела. Подставим это выражение в (1) и найдем изменение энтропии тела в результате теплообмена:

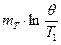 , (2)
, (2)
где 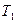 - начальная температура тела (равная температуре кипящей воды в сосуде на электроплитке, находится по таблице зависимости температуры кипения от давления),
- начальная температура тела (равная температуре кипящей воды в сосуде на электроплитке, находится по таблице зависимости температуры кипения от давления), 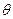 - конечная температура тела (равновесная температура в калориметре после теплообмена).
- конечная температура тела (равновесная температура в калориметре после теплообмена).
Аналогичным образом вычисляется изменение энтропии стакана калориметра с водой:
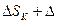
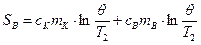 , (3)
, (3)
где 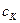 и
и  - удельные теплоемкости калориметра и воды,
- удельные теплоемкости калориметра и воды, 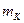 и
и 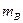 - массы калориметра и воды,
- массы калориметра и воды, 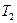 - начальная температура калориметра и воды (комнатная).
- начальная температура калориметра и воды (комнатная).
Изменение энтропии всей системы в результате теплообмена находится сложением (2) и (3):
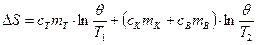 . (4)
. (4)
Это выражение используется для экспериментального определения изменения энтропии системы тел в результате теплообмена в данной лабораторной работе.
Отметим, что так как 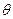 <
< 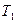 и
и 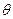 >
>  , то первое слагаемое в выражении (4) отрицательное, а второе – положительное. Тем не менее общее изменение энтропии
, то первое слагаемое в выражении (4) отрицательное, а второе – положительное. Тем не менее общее изменение энтропии 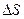 должно быть больше нуля, так как второе начало термодинамики требует [1], чтобы в замкнутой адиабатически изолированной макросистеме (которой является калориметр) энтропия увеличивалась. Проведение лабораторного эксперимента должно подтвердить это положение.
должно быть больше нуля, так как второе начало термодинамики требует [1], чтобы в замкнутой адиабатически изолированной макросистеме (которой является калориметр) энтропия увеличивалась. Проведение лабораторного эксперимента должно подтвердить это положение.
Следует также учесть, что чем больше теплоемкость испытуемого тела (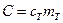 ), тем больше его тепловая энергия (количество поглощенной теплоты) перед погружением в калориметр и, следовательно, тем дальше система тел от состояния равновесия в начале процесса. При этом в процессе теплообмена участвует большее количество теплоты, таким образом, будет больше общее изменение энтропии
), тем больше его тепловая энергия (количество поглощенной теплоты) перед погружением в калориметр и, следовательно, тем дальше система тел от состояния равновесия в начале процесса. При этом в процессе теплообмена участвует большее количество теплоты, таким образом, будет больше общее изменение энтропии 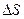 .
.

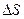 рассчитывается по формуле Клаузиуса:
рассчитывается по формуле Клаузиуса: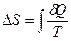 (1)
(1)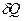 - количество тепла,
- количество тепла, 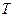 - температура.
- температура.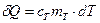 , где
, где 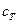 - удельная теплоемкость тела,
- удельная теплоемкость тела,  - масса тела. Подставим это выражение в (1) и найдем изменение энтропии тела в результате теплообмена:
- масса тела. Подставим это выражение в (1) и найдем изменение энтропии тела в результате теплообмена:
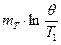 , (2)
, (2)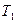 - начальная температура тела (равная температуре кипящей воды в сосуде на электроплитке, находится по таблице зависимости температуры кипения от давления),
- начальная температура тела (равная температуре кипящей воды в сосуде на электроплитке, находится по таблице зависимости температуры кипения от давления), 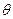 - конечная температура тела (равновесная температура в калориметре после теплообмена).
- конечная температура тела (равновесная температура в калориметре после теплообмена).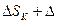
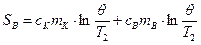 , (3)
, (3)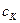 и
и  - удельные теплоемкости калориметра и воды,
- удельные теплоемкости калориметра и воды, 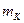 и
и 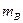 - массы калориметра и воды,
- массы калориметра и воды, 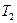 - начальная температура калориметра и воды (комнатная).
- начальная температура калориметра и воды (комнатная).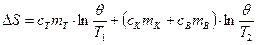 . (4)
. (4) , то первое слагаемое в выражении (4) отрицательное, а второе – положительное. Тем не менее общее изменение энтропии
, то первое слагаемое в выражении (4) отрицательное, а второе – положительное. Тем не менее общее изменение энтропии 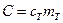 ), тем больше его тепловая энергия (количество поглощенной теплоты) перед погружением в калориметр и, следовательно, тем дальше система тел от состояния равновесия в начале процесса. При этом в процессе теплообмена участвует большее количество теплоты, таким образом, будет больше общее изменение энтропии
), тем больше его тепловая энергия (количество поглощенной теплоты) перед погружением в калориметр и, следовательно, тем дальше система тел от состояния равновесия в начале процесса. При этом в процессе теплообмена участвует большее количество теплоты, таким образом, будет больше общее изменение энтропии 


