Окислители
В таких часто встречающихся в химической практике веществах, как KMnO4, K2CrO4, K2Cr2O7, HNO3, H2SO4 атомы Mn+7, Cr+6, N+5, S+6 находятся в высшей степени окисления и могут проявлять только свойства окислителей. Восстановление этих веществ можно представить следующими схемами.
Mn2+ (в сильнокислой среде) MnO4– MnO2 (в нейтральной, слабокислой и слабощелочной средах)
Как следует из приведённых схем, чем более активен металл и чем более разбавлен раствор кислоты, тем глубже протекает восстановление HNO3.
Как уже было сказано выше, концентрированная H2SO4 также может быть только окислителем за счёт атомов серы в высшей степени окисления.
Однако в разбавленных водных растворах серная кислота, как и её соли, не проявляют окислительных свойствза счёт атомов S+6. Поэтому разбавленные растворы H2SO4 удобно использовать для создания кислой среды.
Следует также учитывать, что молекулы воды сами могут быть окислителем за счёт атома H+1 и при наличии сильного восстановителя (например, щелочного или щелочноземельного металла) восстанавливаться в соответствии со схемой: H2O ® H2.
Аналогичным образом происходит восстановление ионов водорода из кислых растворов активными металлами: 2H+ ® H2.
|




 MnO42– (в сильнощелочной среде)
MnO42– (в сильнощелочной среде)
 Cr3+ (в сильнокислой среде)
Cr3+ (в сильнокислой среде)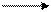 CrO42– и Cr2O72– Cr(OH)3 (в нейтральной, слабощелочной средах)
CrO42– и Cr2O72– Cr(OH)3 (в нейтральной, слабощелочной средах)
 [Cr(OH)4]– или [Cr(OH)6]3– (в сильнощелочной среде)
[Cr(OH)4]– или [Cr(OH)6]3– (в сильнощелочной среде) HNO3 (конц.) NO2 (в реакциях с малоактивными металлами – Pb, Cu, Ag)
HNO3 (конц.) NO2 (в реакциях с малоактивными металлами – Pb, Cu, Ag) HNO3 (разб.) NO (в реакциях с малоактивными металлами – Pb, Cu, Ag)
HNO3 (разб.) NO (в реакциях с малоактивными металлами – Pb, Cu, Ag) HNO3 (очень разб.) NH4NO3 (в реакциях с очень активными металлами – Ca, Mg).
HNO3 (очень разб.) NH4NO3 (в реакциях с очень активными металлами – Ca, Mg).


