Лабораторна робота № 30
ВИЗНАЧЕННЯ МОЛЕКУЛЯРНОЇ МАСИ І ГУСТИНИ ГАЗУ МЕТОДОМ ВІДКАЧУВАННЯ
Мета роботи:ознайомлення з одним із методів визначення молекулярної маси і густини газу. Обладнання: експериментальна установка ФПТ 1-12 Теоретичні відомості Молекулярною (молярною) масою зветься маса одного моля речовини. У системі СІ ця величина вимірюється в кілограмах на моль. Моль - кількість речовини, яка містить стільки ж структурних елементів (молекул, атомів і т.д.), скільки атомів міститься в ізотопі вуглецю 12С масою 0,012 кг. Молярну масу газу можна визначити з рівняння газового стану. При не дуже високих тисках, але досить високих температурах газ можна вважати ідеальним. Стан такого газу описується рівнянням Менделєєва-Клапейрона:
де Р - тиск газу; V - об'єм газу; т - маса газу; μ - молярна маса газу; R = 8,31 Дж/(моль·К) - універсальна газова стала; Т - абсолютна температура газу. З рівняння (30.1) можна одержати формулу для молярної маси газу:
Якщо вимірювання тиску Р, об'єму V, температури Т газу, тобто параметрів газу, які входять до формули (30.2), не викликає особливих труднощів, то визначення маси газу виконати практично неможливо, тому що газ можна зважити тільки разом з колбою, в якій він знаходиться. Існує інший спосіб визначення μ;, який дозволяє виключити невідоме значення маси колби m 0. Це можна зробити, розглянувши рівняння стану двох мас m 1 и m 2 того самого газу при незмінних температурі T та об'ємі V. Нехай у колбі об'ємом V знаходиться газ масою m 1, під тиском Р 1 і за температури Т. Рівняння стану (30.1) для цього газу має вигляд
Відкачаємо частину газу з колби, не змінюючи його температури. Після відкачування маса газу, що залишився у колбі, та його тиск зменшуються. Позначимо їх відповідно m 2 і P 2 і знову запишемо рівняння стану
З рівнянь (30.3) та (30.4) отримаємо:
Одержана формула (30.5) дає можливість визначити μ;, якщо відома зміна маси газу (але не сама маса), а також зміна тиску, температура та об'єм газу. У даній роботі досліджуваним газом є повітря, яке являє собою суміш азоту, кисню, аргону та інших газів. Формула (30.5) придатна і для визначення μ; суміші газів. Знайдене у цьому випадку значення і являє собою деяку середню або ефективну молярну масу суміші газів. Молярна маса суміші газів може бути розрахована і теоретично, якщо відомий процентний вміст та молярна маса кожного з газів, який входить до складу суміші, за формулою
де Якщо відома молярна маса газу, то можна легко визначити ще одну важливу характеристику газу - його густину ρ;. Густина газу - це маса одиниці об'єму газу:
Виразивши m/V з рівняння Менделєєва-Клапейрона, отримаємо
Густину суміші газів можна обчислити за формулою (30.8), розуміючи під μ; ефективну молярну масу суміші.
|

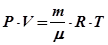 , (30.1)
, (30.1) . (30.2)
. (30.2)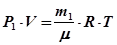 . (30.3)
. (30.3)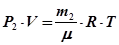 . (30.4)
. (30.4)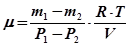 . (30.5)
. (30.5)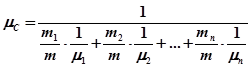 , (30.6)
, (30.6)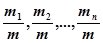 - відносний зміст кожного газу; μ;1, μ;2,…, μ;n - молярні маси газів.
- відносний зміст кожного газу; μ;1, μ;2,…, μ;n - молярні маси газів.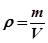 . (30.7)
. (30.7)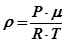 . (30.8)
. (30.8)


