Внутрішня енергія, робота, теплота
Термодинамічна система (ТДС) – це фізична система, що складається з великої кількості мікрочастинок, які беруть участь у тепловому русі, взаємодіють між собою та з навколишнім середовищем, обмінюючись, зокрема, енергією. Термодинамічний процес – це процес переходу системи з одного початкового стану в інший через послідовність проміжних станів. Важливою характеристикою стану термодинамічної системи є її внутрішня енергія U – це кінетична енергія хаотичного теплового руху мікрочастинок (молекул, атомів тощо) і потенціальна енергія їх взаємодії. Внутрішня енергія – однозначна функція стану термодинамічної системи, тобто у кожному стані, який характеризується параметрами P, V, T, система має цілком визначене значення внутрішньої енергії U. Початком відліку внутрішньої енергії звичайно вважають стан при T = 0 К. Хоча при переході з одного стану в інший практичний інтерес має тільки зміна внутрішньої енергії DU, тому вибір початку відліку не має особливого значення. В ідеальному газі не враховуються сили взаємодії між молекулами, а отже, потенціальна енергія молекул дорівнює нулю. Тому внутрішня енергія ідеального газу дорівнює сумарній кінетичній енергії їх теплового руху: U = < e o> N = Тут ураховано, що kNA=R, n=m/M. Внутрішня енергія ідеального газу залежить від виду газу (кількості ступенів вільності молекул) і його абсолютної температури. Обмін енергією ТДС із зовнішнім середовищем може відбуватися двома способами: при силовій взаємодії (шляхом виконання роботи) або шляхом теплообміну. Робота – це форма передавання енергії при силовій взаємодії. Друга форма передавання енергії здійснюється при безпосередньому обміні енергіями між молекулами взаємодіючих тіл, тобто у процесі теплообміну. Таку форму передавання енергії у термодинаміці називають теплотою. Теплообмін відбувається у випадку різниці температури взаємодіючих тіл. Унаслідок теплообміну температури тіл вирівнюються. Робота і теплота мають ту спільну властивість, що вони є характеристикою процесу передавання енергії, а їх числові значення істотно залежать від виду процесу. Проте між роботою і теплотою існує глибока якісна відмінність. Виконання роботи над системою може змінити будь-який вид її енергії – механічної (кінетичної та потенціальної) або внутрішньої. Теплота може змінити тільки внутрішню енергію системи.
|

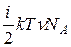 =
= 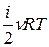 =
= 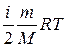 .
.


