Адіабатний процес. Адіабатним процесом називається такий процес, який відбувається без теплообміну термодинамічної системи з навколишнім середовищем (Q12 = 0).
Адіабатним процесом називається такий процес, який відбувається без теплообміну термодинамічної системи з навколишнім середовищем (Q12 = 0). Одним прикладом такого процесу є процес, який відбувається із газом, що знаходиться у посудині з термоізолюючими стінками. Другим прикладом адіабатного процесу є процес, який відбуваються дуже швидко, таким чином, що теплота не встигає передатися навколишньому середовищу. Розглянемо адіабатний процес: (1) ® (2), Q12 = 0, Р1, V1, Т1® V2, Р2, Т2. Перший закон термодинаміки для адіабатного процесу має вигляд:
Робота газу в адіабатному процесі знаходиться з виразу:
Теплоємність в адіабатному процесі: CQ= Cт ï Q= 0 = Рівняння адіабатного процесу: PVg = const, або адіабати, або Інший вигляд рівняння адіабати можна отримати, використавши рівняння Менделєєва–Клапейрона й виразивши з нього тиск через об’єм і температуру або об’єм через тиск і температуру:
Розглянемо застосування першого закону термодинаміки на такому прикладі: у циліндрі під поршнем знаходиться водяна пара масою т за температури Т. Спочатку пара розширилася адіабатно, збільшивши об’єм у n 1 разів, а потім пара була стиснута ізотермічно, причому об’єм пари зменшився у n 2 разів. Визначити кінцеву температуру, роботу, виконану парою у цих процесах, і кількість теплоти, отриманої парою. Температура й об’єм газу в адіабатному процесі (1-2) пов’язані між собою співвідношенням: газу:
Робота газу в ізотермічному процесі (2-3) може бути знайдена за формулою: А23= Сумарна теплота, яка отримана парою, дорівнює роботі, виконаній в ізотермічному процесі: Сумарна робота:
|

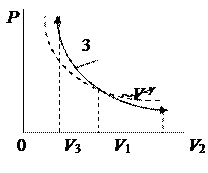
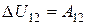 , або
, або  . Тобто в адіабатному процесі робота виконується газом за рахунок зміни його внутрішньої енергії: якщо газ адіабатно розширюється, його робота додатна A 12>0, внутрішня енергія зменшується D U12 <0 і газ охолоджується Т2 < Т1, якщо ж газ адіабатно стискається A 13<0 (
. Тобто в адіабатному процесі робота виконується газом за рахунок зміни його внутрішньої енергії: якщо газ адіабатно розширюється, його робота додатна A 12>0, внутрішня енергія зменшується D U12 <0 і газ охолоджується Т2 < Т1, якщо ж газ адіабатно стискається A 13<0 (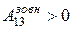 ), його внутрішня енергія і температура зростають D U13 >0, Т3 > Т1 (рис. 2.18).
), його внутрішня енергія і температура зростають D U13 >0, Т3 > Т1 (рис. 2.18).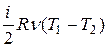 .
.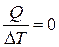 .
.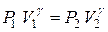 . Цей вираз називають рівнянням Пуассона. Тут
. Цей вираз називають рівнянням Пуассона. Тут 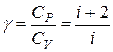 – показник
– показник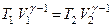 або
або 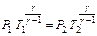 .
.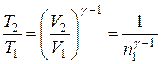 , звідки
, звідки 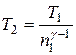 . Показник адіабати
. Показник адіабати 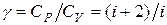 , де і= 6– число ступенів вільності молекул трьохатомного газу Н2О. Оскільки в адіабатному процесі теплообмін відсутній (Q 12=0), робота
, де і= 6– число ступенів вільності молекул трьохатомного газу Н2О. Оскільки в адіабатному процесі теплообмін відсутній (Q 12=0), робота
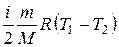 =
= 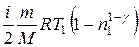 .
.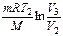 , тобто:
, тобто: 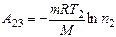 .
.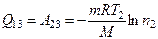 . Знак "-" показує, що теплота була віддана парою в навколишнє середовище при стисканні газу.
. Знак "-" показує, що теплота була віддана парою в навколишнє середовище при стисканні газу.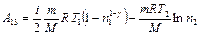 .
. Кінцева температура
Кінцева температура 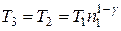 .
.


