Рівняння Ван-дер-Ваальса
Врахуємо для реального газу власний об’єм молекул і дію сил притягання. Наявність сил відштовхування, які не дозволяють проникнути іншим молекулам у зайнятий молекулою об’єм, зводиться до того, що фактичний вільний об’єм, у якому можуть рухатися молекули реального газу, буде меншим, ніж об’єм ідеального газу: Vm® Vm - b, де Vm - b – об’єм одного моля реального газу; b – об’єм, що "заборонений" для руху молекул.
NA – число Авогадро (кількість молекул в одному молі речовини). Дія сил притягання між молекулами реального газу приводить до появи додаткового тиску, що називається внутрішнім тиском: Р ® Р + Р'. Тут Щоб отримати рівняння стану реального газу, уведемо у рівняння Менделєєва–Клапейрона поправки, що враховують власний об’єм молекул і сили притягання молекул. Тоді рівняння стану (для одного моля) набуває вигляду:
Це рівняння називається рівнянням Ван-дер-Ваальса. Враховуючи, що V=nVm (n = m/M – кількість молів), отримаємо рівняння для довільної кількості речовини:
a i b – сталі Ван-дер-Ваальса, постійні для кожного газу величини, що визначаються дослідним шляхом.
|

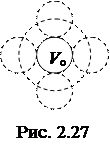 Дві молекули не можуть наблизитися на відстань меншу, ніж сума їх радіусів (d= 2 ro). Тому величина b пропорційна об’єму сфери, яка описана радіусом d,і кількості молекул, які співударяються (рис. 2.27). Розрахунки показують, що b= 4 VoNA,
Дві молекули не можуть наблизитися на відстань меншу, ніж сума їх радіусів (d= 2 ro). Тому величина b пропорційна об’єму сфери, яка описана радіусом d,і кількості молекул, які співударяються (рис. 2.27). Розрахунки показують, що b= 4 VoNA, де Vo – об’єм однієї молекули,
де Vo – об’єм однієї молекули,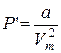 – додатковий тиск, який, згідно з розрахунками Ван-дер-Ваальса, обернено пропорційний квадрату молярного об’єму газу, а – стала Ван-дер-Ваальса, яка характеризує сили міжмолекулярного притягання.
– додатковий тиск, який, згідно з розрахунками Ван-дер-Ваальса, обернено пропорційний квадрату молярного об’єму газу, а – стала Ван-дер-Ваальса, яка характеризує сили міжмолекулярного притягання.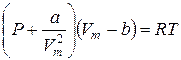 .
.
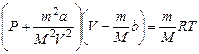 .
.


