Ізотерми реального газу
З рівняння Менделєєва–Клапейрона виходить, що при Т = const і m = const залишається постійним добуток PV = const, тобто це ізотермічний закон Бойля-Маріотта, звідки P=const/V. З рівняння Ван-дер-Ваальса випливає більш складна залежність P = f(V) при постійній температурі:
Отримане рівняння є алгебраїчним рівнянням третього степеня відносно молярного об’єму. Ізотерми газу, які описуються рівнянням Ван-дер-Ваальса, мають вигляд, наведений на рис. 2.28. Існує критична температура Т к: при T>Т к ізотерми реального газу майже не відрізняються від ізотерм ідеального газу, при T<Т к є область станів, де ізотерма має хвилеподібну ділянку і кожному значенню тиску відповідають три точки ізотерми. При підвищенні температури ці точки зближуються і при T=Т к зливаються в одну точку К, яка є точкою перегину ізотерми при T=Т к. Розглянемо ізотерму при T<Т к (рис. 2.29). На ділянках 1-3 і 5-7 при зменшенні об’єму тиск зростає, що відповідає експериментальним даним. Частина ізотерми 1-2 відповідає газоподібному стану, а частина 6-7 – рідині. На ділянці 3-5 стискання речовини приводить до зменшення тиску, що не може бути реалізовано у природі. Істинна ізотерма на цій ділянці має вигляд прямої лінії 2-4-6. У станах, що відповідають горизонтальній лінії 2-4-6, спостерігається рівновага рідкої та газоподібної фази речовини. Речовина у газоподібному стані при T<Т к називається парою, а пара, що знаходиться у рівновазі зі своєю рідиною, називається насиченою парою. На ділянці 2-3, яка є продовженням гілки ізотерми 1-2, речовина перебуває у стані перенасиченої пари за відсутності центрів конденсації. Такий стан називається метастабільним. Він є нестійким, достатньо навіть пилинці потрапити у пару, щоб уся речовина розпалася на дві фази і перейшла із ділянки 2-3 на пряму 2-4. Ділянка 6-5 є продовженням гілки 7-6 і відповідає метастабільному стану перегрітої рідини. Рідина з точки 6 може бути переведеною у точку 5 без кипіння, але досить малої "затравки", щоб рідина почала бурхливо кипіти і перейшла з ділянки 6-5 на пряму 6-4. Висновки, які були отримані з аналізу рівняння Ван-дер-Ваальса, були підтверджені дослідами Ендрюса, що вивчав ізотермічне стискання вуглекислого газу й отримав на ізотермах горизонтальну ділянку 2-4-6. При підвищенні температури до критичної Т = Т к отримуємо критичну ізотерму без хвилеподібних ділянок. При цій температурі зникає різниця між газоподібним і рідким станом речовини. Відповідні тиск Р к і молярний об’єм Vm к також називаються критичними, а стан з критичними параметрами речовини Р к, Vm к, Т к називається критичним станом. Критичні параметри Р к, Vm к, Т к можна знайти з рівняння Ван-дер-Ваальса через сталі a i b:
Пара відрізняється від інших газоподібних станів тим, що при ізотермічному стисканні відбувається процес зрідження. А газ, який знаходиться при температурі вищій за критичну T>Т к, не може бути перетворений стисканням на рідину.
одержуємо
Оскільки V2 > V1,то T1 >T2, тобто реальний газ при адіабатному розширенні у вакуум охолоджується.
Теплопрові́дність — здатність речовини переносити теплову енергію, а також кількісна оцінка цієї здатності. Явище теплопровідності полягає в тому, що кінетична енергія атомів й молекул, яка визначає температуру тіла, передається атомам і молекулам у тих областях тіла, де температура нижча. Теплопровідність не єдиний шлях, яким тепло передається від тіла з вищою температурою, до тіла з нижчою температурою. Така теплопередача може також відбуватися за рахунок теплового випромінювання і конвекції. Різниця між теплопровідністю й конвекцією в тому, що при конвекції тепло переноситься разом із речовиною, а при теплопровідності переносу речовини немає. При теплопровідності величина потоку тепла визначається різницею температури між різними областями тіла. Кількісно теплопровідність характеризується коефіцієнтом теплопровідності κ, який входить в рівняння (закон Фур'є)
Тут Коефіцієнт теплопровідності вимірюється у Вт/(м·K)
|

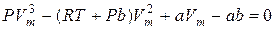 .
.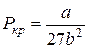 ,
,  ,
,  .
.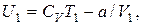
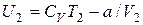 ,
,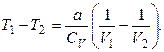
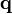 — тепловий потік, T — температура,
— тепловий потік, T — температура, 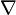 — оператор Гамільтона набла, яким позначається градієнт.
— оператор Гамільтона набла, яким позначається градієнт.


