Первое начало термодинамики. Как было установлено на основе молекулярно-кинетической теории(МКТ), любой ансамбль — множество частиц — молекул обладает специфической энергией
Как было установлено на основе молекулярно-кинетической теории (МКТ), любой ансамбль — множество частиц — молекул обладает специфической энергией, связанной с их движением и взаимодействием этих частиц и называемой внутренней энергией. Для обычного двухатомного идеального газа было выведено (см. гл. 1), что его внутренняя энергия полностью определяется количеством ν газа и его температурой и равна:
Главное же — внутренняя энергия — характеристика состояния газа. Теперь поставим себе цель включить эту внутреннюю энергию в общий закон сохранения. Исторически именно возможность включения внутренней энергии в общий закон сохранения энергии и послужила толчком и поводом к обоснованию всеобщности понятия «энергия», которая до этого считалась просто одной из «удобных», и не более того, характеристик движения. Решающим соображением, которое привело к общеизвестному, теперь общему, и даже всеобщему, распространению применения понятия энергии, стало то, что внутреннюю энергию можно изменять, совершая работу. Напомним, что так же изменяют энергию механическую. Действительно, потрем ладони друг о друга. Совершали работу, двигали ладони, преодолевали силу трения, а получили повышение температуры — величины, определяющей внутреннюю энергию. Количественно все вычисления будем проводить, имея в виду газ. Результаты будут иметь общее значение. Обычно количество газа ν фиксировано. Тогда работу можно выразить через параметры газа (рис. 2.1 и 2.2).
Рис. 2.1. Работа газа над внешними телами. A = Fh = (F / S) hS = p Δ V
Рис. 2.2. Работа внешних тел над газом. A ʹ = – Fh = –(F / S) hS = – p Δ V Исходя из определения работы, как произведения величины силы F на величину малого перемещения h и на косинус угла α между ними, имеем
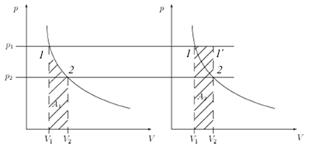
где S — площадь поршня, а изменение объема Δ V ≈ dV cosα. Теперь осталось понять — между какими направлениями брать угол. Если газ расширяется, то, как видно из рис. 2.1, сила, действующая со стороны газа на «внешние тела» (поршень), сонаправлена с перемещением, а сила (см. рис. 2.2), действующая со стороны внешних тел на газ, направлена противоположно перемещению. Поэтому: δ A = pdV = – δ A ʹ. (2.3) Очевидно, что δ A — работа газа, а δ A ʹ — работа внешних сил. Поскольку вся эта наука родилась из практических задач, связанных с работой машин (машина по определению — это устройство для преобразования энергии), то принято работу газа — «полезную» — обозначать А, а равную ей, но противоположную по знаку, работу внешних сил над газом обозначать А ʹ. Обратим внимание, что работу перехода между двумя состояниями лучше записывать именно δ А, а не Δ А. Знак Δ подразумевает разность двух значений, характеризующих состояния. Например, Δ V = V 2 – V 1 — разность объемов второго и первого состояний. Работа же δ А = А 1;2 — работа по переходу из первого состояния во второе, но не разность каких-либо работ, хотя может быть мала, и тогда математически эквивалентна дифференциалу δ А = dА. Конечно, формула (2.3) определяет лишь работу «в малом» — дифференциал. Вся работа будет интегралом, а на графике площадь между линией графика и осью, когда график задан в координатах V – р. На графике (рис. 2.3) хорошо видно, что работа не является функцией состояния и определяется способом перехода из 1 в 2. Площади на левом и правом рисунках не равны, работа перехода при изотермическом процессе А 2меньше, чем работа А 2при переходе по изобаре 1 – 1 ʹ и потом по изохоре 1 ʹ– 2 в то же самое конечное состояния.
Рис. 2.3. Работа газа Кроме работы существует еще один способ изменения внутренней энергии. Это передача газу теплотыQ или получение от газа теплоты Q ʹ. Подчеркнем, что у работы «штрих» ставится, когда вычисляется работа над газом (внешних сил). У теплоты «штрих» ставится, когда теплота идет от газа, так сложилось исторически. Когда все убедились (после опытов Джоуля), что теплота может быть преобразована в работу, то и включили внутреннюю энергию в Энергию с большой буквы. С тех пор в эту Энергию стали включать энергии и всех новых сущностей: атомную энергию, ядерную энергию, химическую связь (ее энергию) и т. д. До доказательства эквивалентности теплоты и работы их даже измеряли в разных единицах. Единица количества теплоты, калория, и до сих пор встречается в биологии и химии. Запомним: 1 кал =4,2 Дж. Для характеристики передаваемой теплоты вводится понятие теплоемкости. В самом этом слове — емкости — слышен реликт, остаток древности. В нем слышны отголоски теории особой жидкости, несущей теплоту — «теплороде». Теперь теплоемкость — это не более чем удобная характеристика молекулярного движения — коэффициент пропорциональности между теплотой и изменением температуры. Реально тела характеризуются удельной теплоемкостью или молярной теплоемкостью. Для твердых и жидких тел это величины, не зависящие от параметров состояния, и их численные значения для разных веществ приводятся в справочниках. Удельная теплоемкость с определяется по формуле: δ Q = cmdT. (2.4) Единица измерения удельной теплоемкости — Дж/(кг ⋅ К). Именно эта величина используется в школьном курсе физики. Молярная теплоемкость с определяется по формуле: δ Q = c ν dT. (2.5) Единица измерения молярной теплоемкости — Дж/(моль ⋅ К).Именно эта величина используется в курсе химии и в этом курсе физики. Отметим, что единица измерения молярной теплоемкости совпадает с единицей измерения универсальной газовой постоянной R = 8,31 Дж/(моль ⋅ К). Отсюда сразу следует (размерность!), что связь между этими величинами — просто число. О теплоте можно сказать то же самое, что уже говорилось о работе. Теплота не является функцией состояния δ Q —не разность теплот двух состояний. Итак, первое начало термодинамики (первый закон термодинамики) можно записать в виде: δ Q = δ A + δ U; δ U = δ Q – δ A. (2.6) Теплота, переданная телу (системе), расходуется на совершение системой работы и на изменение ее внутренней энергии. Или иначе, изменение внутренней энергии равно количеству теплоты, переданной газу без учета (за вычетом!) работы, совершенной газом. Если тело движется, то энергия движения также должна включаться в этот закон. Более того, если о чем-то ничего не известно, то к этому «чему-то» можно применить закон сохранения энергии! Рассмотрим применение первого закона к изопроцессам.
|

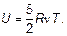 (2.1)
(2.1)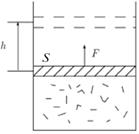

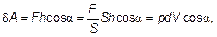 (2.2)
(2.2)