По определению этого процесса объем постоянен. Следовательно, Δ V = 0, δ А = 0 — работа в изохорном процессене совершается. Из первого начала термодинамики тогда следует, что изменение внутренней энергии равно теплоте dU = δ Q. Сопоставляя формулы внутренней энергии газа (2.1) и теплоты (2.5), которую запишем в виде δ Q = сV ν dT, где сV — так называемая молярная теплоемкость при постоянном объеме, получим:
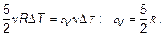 (2.7)
(2.7)
Очевидно, что молярная теплоемкость идеального газа зависит только от «атомности» этого газа (от числа степеней свободы). Для одноатомного газа было бы сV = 3 R /2.

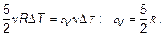 (2.7)
(2.7)


