Распределение Максвелла
Распределение Максвелла — это распределение молекул по модулю, по величине скорости. Так как по величине скорость определяется тремя ее проекциями, а проекции могут иметь независимые значения, то согласно правилу перемножения вероятностей (см. п. 3.3) имеем:
Конечно, при записи этой формулы использован и принцип (распределение) Больцмана. Распределение по направлениям может быть «уничтожено» интегрированием по углам θ и φ, определяющим направление вектора скорости. Очевидно, что
Этот результат можно было предвидеть в соответствии с законом Больцмана. Ведь W к= m 0 V 2/2. Теперь выразим dVxdVydVz через модуль скорости и углы, задающие ее направление. Для этого используем, что произведение dxdydz — это элемент объема («малый объем»). Также и dVxdVydVz — малый объем в пространстве скоростей. Переход от Vx; Vy; Vz — проекций скоростей в декартовых координатах (см. рис. 3.5 и 3.9) к модулю скорости
Рис. 3.9. Переход от проекций скоростей Vx; Vy; Vz к модулю скорости V
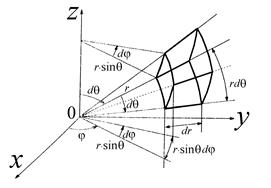
Рис. 3.10. Переход от декартовых координат x, y, z к сферическим r, θ, φ Сравнивая рис. 3.9 и 3.10, видим, что переход от элемента объема в пространстве скоростей в декартовых координатах dVxdVydVz,к элементу объема также в пространстве скоростей,
Рис. 3.11. Элемент объема dxdуdz в декартовой системе координат. В пространстве скоростей ему соответствуют dVxdVydVz
Рис. 3.12. Элемент объема dr ⋅ rd θ ⋅ r sinθ d φ в сферических координатах. Очевидно, что для перехода от «пространства координат» к «пространству скоростей» (см. рис. 3.12) нужно заменить х на Vх, у на Vу, z на Vz, радиус-вектор
Легко провести интегрирование по углам. Интегрируем
и записываем формулу, позволяющую вычислить вероятность, что молекула имеет скорость с величиной, лежащей в интервале между V и V + dV.
Распределение вероятности имеет вид (рис. 3.13):
Рис. 3.13. Распределение Максвелла Именно это распределение и называется распределением Максвелла. Количество молекул, имеющих скорость, лежащую между V и V + dV, будет:
а функция распределения количества молекул, соответственно,
Как видно из формулы (3.30), вид кривой распределения зависит от природы молекул (в формулу входит молярная масса М) и от температуры. На рис. 3.14 приведены кривые распределения молекул азота по скоростям при различных температурах. При повышении температуры вся кривая смещается в сторону больших скоростей (положение максимума, т. е. V нвпропорционально
Рис. 3.14. Распределение Максвелла для данного газа при нескольких температурах
|

 (3.24)
(3.24)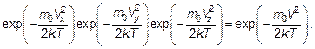 (3.25)
(3.25)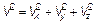 и углам θи φ совершенно аналогичен переходу от декартовых координат х; у; z к сферическим координатам с расстоянием r 2= х 2 + у 2 + z 2и теми же углами θ и φ (рис. 3.10).
и углам θи φ совершенно аналогичен переходу от декартовых координат х; у; z к сферическим координатам с расстоянием r 2= х 2 + у 2 + z 2и теми же углами θ и φ (рис. 3.10).

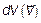 , но выраженному через модуль скорости V и углы θ и φ, полностью аналогичен (совпадает!) с переходом от элемента объема в декартовых координатах dxdydz (рис. 3.11) к элементу объема
, но выраженному через модуль скорости V и углы θ и φ, полностью аналогичен (совпадает!) с переходом от элемента объема в декартовых координатах dxdydz (рис. 3.11) к элементу объема 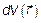 в сферических координатах (рис. 3.12)
в сферических координатах (рис. 3.12)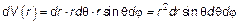 (3.26)
(3.26)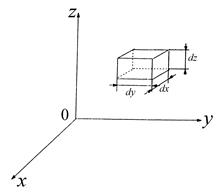
 на вектор скорости
на вектор скорости  , а радикальную координату
, а радикальную координату 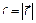 на модуль скорости
на модуль скорости 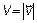 . Тогда элемент объема в пространстве скоростей dVxdVydVz преобразуется в
. Тогда элемент объема в пространстве скоростей dVxdVydVz преобразуется в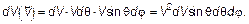 (3.27)
(3.27) (3.28)
(3.28)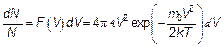 (3.29)
(3.29) (3.30)
(3.30)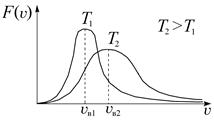
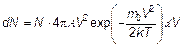 (3.31)
(3.31) (3.32)
(3.32)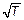 ). Площади под этими кривыми остаются, конечно, неизменными и равными единице, ведь это сумма всех вероятностей того, что молекулы имеют хоть какую-нибудь скорость. Вследствие этого максимум кривой при повышении температуры уменьшается.
). Площади под этими кривыми остаются, конечно, неизменными и равными единице, ведь это сумма всех вероятностей того, что молекулы имеют хоть какую-нибудь скорость. Вследствие этого максимум кривой при повышении температуры уменьшается.



