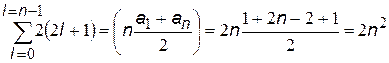Принцип Паули. Периодическая система элементов.
В 1925 г Паули, исследуя спектры многоэлектронных атомов, открыл фундаментальный закон, которому подчиняются электронные конфигурации атомов, имеющих более одного электрона. Принцип Паули: «Никакие два электрона в атоме не могут находиться в одном и том же квантовом состоянии, каждый электрон должен иметь свой набор квантовых чисел n, l, m, ms». Принципу Паули подчиняются не все микрочастицы, а только те, которые имеют полуцелый спин – электрон, протон, нейтрон, нейтрино. Частицы с полуцелым спином называют фермионами (см. дальше). Принцип Паули объясняет, почему электроны в многоэлектронных атомах образуют энергетические оболочки и подоболочки. Распределение электронов в атомах определяется: 1) принципом Паули и 2) принципом наименьшей энергии [xvii] Найдем количество электронов, имеющих заданные квантовые числа.
Магнитное собственное квантовое число ms может принимать два значения, поэтому принцип Паули формулируют еще и так: в одном энергетическом состоянии могут находиться два электрона, но с разнонаправленными спинами. Общее число орбитальных квантовых чисел m равно (2 l + 1). Количество электронов с одинаковыми n можно найти как алгебраическую сумму
Удобно представить заполнение электронами оболочек и подоболочек атомов в виде таблицы.
Подобное распределение является идеализированным. Оно было бы таким, если бы каждый электрон в атоме взаимодействовал только с ядром атома. В действительности данный электрон испытывает действие остальных электронов атома. Часто энергетически выгодным оказывается состояние, когда нижняя оболочка заполнена неполностью, а начинает заполняться следующая. Нарушения в заполнении электронных оболочек атомов наблюдаются у № 19 – калий и более тяжелых элементов. Электронную конфигурацию атомов принято выражать формулой:
Здесь 1, 2, 3,… - главные квантовые числа, s, p, d,… - буквенные обозначения орбитальных квантовых чисел l, верхние числа – количество электронов с данными n и l. Сумма верхних чисел дает общее количество электронов в данном атоме. Таблица элементов, предложенная Д.И. Менделеевым (1869г) на основе их химических свойств, с открытием электронного строения атомов полностью объясняется электронной конфигурацией атомов.
|