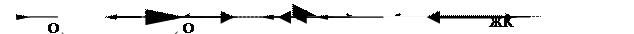Роль нарушений перекисного статуса при заболеваниях пародонта.
Этиопатогенез заболеваний пародонта многогранен, в настоящее время раскрыты его многие ключевые механизмы. Одни авторы считают, что при деструкции пародонта изменения тканей происходят, в основном, за счет микробной инвазии; другие видят причину развития патологического процесса в нарушениях общего и местного иммунитета, некоторые придерживаются мнения о нарушении процессов липопероксидации, и, как следствие, мембранодеструкции. В последние годы накоплен обширный клинический и экспериментальный материал об изменениях местного иммунного, коагулологического потенциала, о сдвигах в системе «ПОЛ – антиоксидантная защита» в генезе патологии пародонта. Одной из главных причин воспалительных изменений в пародонте является зубная бляшка, способствующая инвазии микрофлоры в ткани и последующему развитию воспалительно-деструктивного процесса с рассасыванием костной ткани альвеолярных отростков челюстей. Влияние иных местных и общих факторов расценивается как второстепенное, не имеющее решающего значения для развития и прогрессирования заболевания. В то же время результаты клинических и экспериментальных работ свидетельствуют о весьма значимой роли нейроэндокринных, нейроиммунных, психологических и других факторов в патогенезе воспалительно-дистрофического процесса в пародонте. Одним из главных биохимических звеньев начальных патологических изменений в тканях пародонта считается активация свободнорадикального окисления. Пародонт представляет собой в биохимическом отношении многокомпонентную тканевую систему, находящуюся в морфофункциональном единстве и состоящую из множества структурных элементов – клеток. Биологические мембраны – это надмолекулярные образования, отделяющие клетки друг от друга и осуществляющие компартментализацию внутри них. Они состоят из белков и липидов и представляют собой асимметричные, плоские, замкнутые, бислойные структуры, обладающие внешней и внутренней поверхностями. Для всех мембранных структур присущи реакции перекисного окисления, которые необходимы для самообновления, самоперестройки мембран, их репарации. Определенный уровень скорости реакций свободнорадикального окисления липидов присущ любой нормально функционирующей ткани. Изменение интенсивности перекисного окисления липидов является ответом клетки на любой стресс при воздействии внешних и внутренних факторов. Он представляет собой процесс непосредственного переноса кислорода на субстрат с образованием пероксидов, кетонов, альдегидов, причем характерной чертой реакции является ее цепной, самоиндуцирующий характер. На рис. 10 представлена краткая схема реакций перекисного окисления липидов и систем их регуляции.

Рис. 10. Краткая схема процессов ПОЛ и систем их регуляции.
В качестве инициаторов перекисного окисления выступают свободные радикалы, образованные в результате катаболизма и окислительно-восстановительных процессов. В основном это активные формы кислорода, а также оксиды азота и серы. К образованию данных соединений приводят различные полимеры, химизация продуктов сельского хозяйства, определенный уровень радиации и ультрафиолетового излучения, которые способствуют активации перекисного окисления. Активные формы кислорода образуются не только за счет экзогенных факторов, но и эндогенным путем: в цепи переноса электронов в митохондриях и эндоплазматической сети, в метаболизме пуринов, при активации гексозомонофосфатного шунта в фагоцитирующих клетках и др. Образование свободных радикалов тесно связано с метаболизмом кислорода. В результате ферментативных или спонтанных процессов образуются промежуточные продукты, обладающие повышенной окисляющей способностью: супероксид-анион, синглетный кислород и гидроксильные радикалы. Субстратами для них, в первую очередь в гидрофобной части мембраны, являются полиненасыщенные жирные кислоты. Безусловно, последние – не единственная мишень для атаки свободных радикалов, однако ведущая роль фосфолипидов, содержащих значительное количество полиеновых жирных кислот, в структурно-функциональной организации мембранных образований делает их наиболее вероятными субстратами свободнорадикальных реакций. Сущность патогенного действия свободных радикалов заключается в их структуре. У свободных радикалов, в отличие от обычных химических веществ, на внешней орбите располагается неспаренный электрон. Такая частица является чрезвычайно реакционноспособной и может атаковать и изменять конформацию молекул, приводя к нарушению их функций. Процесс пероксидации сопровождается: деформацией мембранно-липидного комплекса, увеличением проницаемости для Н+ и воды, ингибированием мембранных ферментов, появлением «пор» в структуре, а в конечном итоге цитолизом и гибелью клетки. Общими признаками мембранной патологии, вызванной активацией перекисного окисления липидов, являются: увеличение гидрофильности мембран и, вследствие этого, усиление их проницаемости для ионов кальция, других ионов, разобщение тканевого дыхания и окислительного фосфорилирования, нарушение ферментных функций, ослабление связи фосфолипидов со структурными и рецепторными белками мембран, инактивация тиоловых энзимов, SH-групп аминокислот и белков, повреждение ДНК, набухание и лизис мембран с последующим аутолизом клетки. Повышение уровня пероксидов липидов и продуктов их дальнейшего катаболизма при ряде заболеваний способствовали созданию представления о реакциях перекисного окисления липидов, как о нежелательном и абсолютно патологическом процессе. Тем не менее, существование ферментативных систем регуляции реакций перекисного окисления свидетельствует о том, что это нормальный метаболический процесс, необходимый для самообновления и самоперестройки мембранных структур, регуляции ионного транспорта и активности мембраносвязанных ферментов, образования многих биологически активных соединений (системных и локальных гормонов). Ключевым вопросом в понимании механизмов регуляции антиокислителей является их соотношение с уровнем перекисного окисления. Многочисленными исследованиями доказано, что баланс в системе «перекисное окисление – антиоксиданты» является физиологической константой. Более того, показано, что чувствительность этой регуляторной формации сохраняется и при введении экзогенных радикальных ингибиторов, при этом состав фосфолипидов, их окисляемость, скорость расхода антиоксидантов и их концентрация строго уравновешены. Воздействия, изменяющие параметры какого-либо звена этой цепи, приводят к изменениям всей системы, в результате чего свободнорадикальные процессы возвращаются в норме на стационарный уровень. В физиологических условиях продукты ПОЛ инактивируются антиоксидантной системой, которая представлена факторами ферментативной (супероксиддисмутаза, каталаза, система «глутатионпероксидаза-глутатионредуктаза») и неферментативной (витамины А, Е, С, глутатион, цистеин и др.) природы, при недостатке которой воспалительно-деструктивный процесс прогрессирует. Как повысить антиоксидантный статус организма, нормализовать ослабленные функции его иммунной системы и мобилизовать имеющиеся резервы, показали результаты исследований, проведенных в Научном центре экспертизы и государственного контроля лекарственных средств при Министерстве здравоохранения России. По разработанной в центре методике были выявлены связи между величиной антиоксидантной активности пищевых продуктов, фитопрепаратов и содержанием в них биологически активных веществ в пересчете на флавоноид – кверцетин, присутствующий во многих лекарственных растениях и принятый в качестве стандарта. Свободные радикалы вследствие присутствия на их внешней орбите одного или нескольких неспаренных электронов обладают высокой деструктивной активностью и становятся существенным фактором воспалительного процесса. Альтеративное действие свободных радикалов на клеточные мембраны реализуется активацией перекисного окисления липидов (ПОЛ), вследствие чего в тканях образуются высокотоксичные продукты: малоновый диальдегид, основания Шиффа. В физиологических условиях вышеуказанные продукты инактивируются антиоксидантной системой, которая представлена факторами ферментативной (супероксиддисмутаза, каталаза, система «глутатионпероксидаза-глутатионредуктаза») и неферментативной (витамины А, Е, С, глутатион, цистеин и др.) природы, при недостатке которой воспалительно-деструктивный процесс прогрессирует. Описано множество причин активации свободнорадикального окисления – гипероксия, недостаток биоантиоксидантов в пище, генетические ферментативные дефекты, избыточное употребление алкоголя и др. Однако одной из наиболее частых является тканевая гипоксия. При пародонтите вследствие нарушения микроциркуляции в тканях пародонта отмечается недостаток кислорода и усиление ПОЛ. В этих условиях защита тканей обеспечивается увеличением активности антиоксидантной системы, состояние которой поддерживает адаптационно-приспособительные реакции целостного организма. Данные литературы, касающиеся вопросов изменения параметров свободнорадикального окисления при воспалении пародонта довольно скудны. Так, при патологии, вследствие нарушения микроциркуляции в тканях пародонта, отмечается недостаток кислорода и усиление ПОЛ. В этих условиях защита тканей обеспечивается увеличением активности антиоксидантной системы, состояние которой поддерживает адаптационно-приспособительные реакции целостного организма. Параллельно, наряду с усилением локального протеолиза, происходит интенсификация липопероксидации и эти два процесса стимулируют друг друга, усугубляя негативные последствия их чрезмерной активации. К отличительным признакам антирадикальной цепи пародонта следует отнести более низкий уровень тиоловых антиоксидантов (глутатион) по сравнению с другими тканями. В пародонте относительно высок уровень аскорбата по сравнению с тканью аорты, миокарда и мозга. Из ферментативных радикальных ингибиторов в ткани пародонта высока активность каталазы и супероксиддисмутизы. Таким образом, для системы антиоксидантной защиты пародонта особое значение имеет каталаза, аскорбиновая кислота и биофлавоноиды, что подтверждается клиническими данными: при их недостаточности наблюдается развитие деструктивных изменений, обусловленных интенсификацией реакций липопероксидации. В целом антиоксидантная система пародонта по основным элементам аналогична системе антиоксидантной защиты сосудистой стенки, хотя имеет ряд отличий, обусловленных многообразием структурных элементов, входящих в состав ткани, окружающей зуб. Современные теории генеза патологии пародонта, представления о ведущей роли сосудистых изменений в данном процессе, позволяют сформировать следующую концепцию участия свободнорадикального окисления в развитии данного страдания. Факторы риска обуславливают исходную фоновую относительную недостаточность антиокислительной защиты. Такая функциональная неполноценность системы ингибирования свободнорадикальных реакций приводит к развитию в мягких тканях пародонта пероксидного стресса под влиянием провоцирующих факторов, в первую очередь, утечки радикала О2- при ''дыхательном взрыве'' фагоцитирующих лейкоцитов, накапливающихся в десневой жидкости и тканях десны под влиянием признанных местных факторов (зубной налет, бляшка, ассоциация микробов). Полиморфноядерные лейкоциты, гидролазы и кинины, участвующие генезе воспаления, освобождаемые этими клетками эйкозаноиды, обуславливают фазы дилятации и спазма сосудов и иммунологические нарушения. Развивающаяся последовательно гипероксия – гипоксия пародонта, возможная диффузия продуктов свободнорадикального окисления из мягких тканей приводит к вторичной вспышке воспаления в костной ткани. Неферментативное перекисное окисление липидов костной ткани, атеросклероз питающих ее сосудов, иммунологические расстройства и нарушения баланса в ней эйкозаноидов в комплексе индуцируют деструкцию коллагеновых волокон и резорбцию альвеолярного отростка. Изложенные данные выдвигают вопросы о накоплении продуктов липопероксидации в десневой жидкости и десне при разном гигиеническом состоянии полости рта и в зависимости от стадии заболевания; возникает вопрос о состоянии пародонта у лиц с врожденной недостаточностью антиоксидантных ферментов (известен пародонтит, как проявление акаталазии). Вместе с тем, концепция участия свободнорадикального окисления в генезе патологических сдвигов в пародонте указывает на целесообразность разработки первичной дифференцированной фармакопрофилактики пародонтита биоантиоксидантами и другими биорегуляторами, которая в современных условиях должна дополнить обычные меры личной и профессиональной гигиены. Таким образом, информация о состоянии процессов липопероксидации и систем их регуляции характеризует один из биохимических аспектов механизма «адаптации-дизадаптации». Проявившись первоначально на уровне адаптационного эффекта перекисного стресса, в дальнейшем активация перекисного окисления липидов может перерастать в одно из звеньев патогенеза тех или иных заболеваний или, напротив, предотвратить его. Лимитирующим фактором в данной ситуации является соотношение в организме прооксидантных и антиоксидантных систем, составляющих общий окислительный потенциал. Резюмируя вышеизложенное, можно констатировать следующее: - дисбаланс в системе «перекисное окисление липидов – антиоксиданты» является существенным патогенетическим звеном заболеваний пародонта; - необходимость понимания особенностей влияния на ткань пародонта в условиях лечебных манипуляций, знание компенсаторно-приспособительных механизмов, возникающих при этом, является основанием для разработки методов профилактики развития патологии пародонта. Воспаление пародонта сопровождается повышением концентрации в слюне катепсинов D и B и слабощелочных протеиназ. При этом уменьшается активность ингибиторов протеиназ, в том числе и a1-антитрипсина, но увеличивается в 1,5 раза активность местно вырабатываемых кислотостабильных протеиназ. При пародонтите меняется скорость нитратредуктазной реакции и содержание нитритов; кроме того, характерно повышение активности гиалуронидазы и b-глюкуронидазы. Интенсивность пероксидазных процессов в слюне возрастает в 1,5 раза, а содержание лизоцима падает на 20-40%. Изменения в защитных системах сочетаются с увеличением количества тиоцинатов в 2-3 раза. Таким образом, биохимические сдвиги при пародонтите характеризуются сочетанием местных и общих факторов, что необходимо учитывать при проведении патогенетической терапии. В заключение хотелось бы отметить, что в работе любого врача вообще и стоматолога, в частности, очевидна необходимость рассмотрения последствий вмешательства на всех уровнях сложных, единых механизмах поддержания гомеостаза и реактивности организма. При выполнении любых лечебных манипуляций следует учитывать индивидуальное состояние обменных процессов у пациентов, иммунной и других систем организма, местной защиты полости рта, взаимодействие и согласованность которых обеспечивает сохранение здоровья и качество жизни.
СПИСОК ЛИТЕРАТУРЫ 1. Авцын А.П., Жаворонков А.А., Риш М.А., Строчкова Л.С. Микроэлементозы человека: М.: Медицина. - 1991. - С. 280-301. 2. Боровский Е.В., Леонтьев В.К. Биология полости рта. - М.: Медицина. - 1991.- 304с. 3. Боровский Е.В., Леонтьев В.К. Биология полости рта. - М.: Медицина. - 2003.- 294с. 4. Вавилова Т.П. Избранные лекции по стоматологической биохимии.- М.: ММСИ, 1994.- 51 с. 5. Гнатюк П.Я. Профилактика флюороза зубов //Здравоохранение Кишинева. - 1988. - № 4.- С. 42-43. 6. Григорьев И. В., Чиркин А. А. Роль биохимического исследования слюны в диагностике заболеваний // Клин. лаб. диагн.- 1998.- № 6.- 18-20 с. 7. Денисов А.Б., Леонтьев В.К., Петрович Ю.А. Типовые формы патологии слюнных желез.- М.:ММСИ, 1996.- 150 с. 8. Елизарова В. М., Петрович Ю. А. Ионизированный кальций в слюне детей при множественном кариесе // Стоматология.- 1997.- № 4.- 6-8 с. 9. Зельтцер С., Бендер И. Пульпа зуба: Пер. с англ. - М.: Медицина. - 1971.- 223с. 10. Иванов В.С. Заболевания пародонта. - М.: Медицина. - 1989.- 272с. 11. Канканян А.П. Определение активности миелопероксидазы в слюне как дифференцирующий тест для диагностики заболеваний пародонта // Новое в стоматологии.- 1996.- № 1.- 28-29 с. 12. Коробейникова Э. Н., Ильиных Е. И. Количественное определение содержания белка и муцина (гликопротеинов) в слюне // Клин. лаб. диагн.- 2001.- № 8. - 34-35 с. 13. Коротько Г. Ф., Готовцева Л. П., Булгакова В. А. Постпрандиальные трансформации ферментных и гормональных свойств слюны и крови // Рос. физиол. журн. им. И. М. Сеченова.- 2002.- № 3.- 396-405 с. 14. Лукиных Л.М., Гажва С.И., Казарина Л.Н. Кариес зубов. - Н.Новгород: Изд-во НГМА, 1996. - 129с. 15. Николишин А.К. Флюороз зубов.- Автореф. дис.... док. мед. наук.- М., 1989.- 45с. 16. Пахомов Г.Н. Первичная профилактика в стоматологии.- М.: Медицина, 1982.- 239с. 17. Петрович Ю. А., Подорожная Р. П., Генесина Т. И., Белоклицкая Г. Ф. Активность глутаматдегидрогеназы, γ-глутамилтранспептидазы и креатинкиназы в слюне при воспалении десны // Патол. физиология и эксперим. терапия.- 1996.- № 4.- 28-30 с. 18. Пинелис Т.П., Гладких И.Ю. Влияние фтора в питьевой воде на структуру стоматологических заболеваний у детей // Экологическая патология и ее фармакокоррекция.- Чита, 1991.- С. 22-24. 19. Ростока Д., Кройча Ю., Кузнецова В., Бразма Д., Рейнис А. Слюна и кариес зубов: диагностические тесты в зубоврачебной практике // Стоматология.- 2001.- № 5.- 7-10 с. 20. Слюна: ее значение для здоровья при заболеваниях // Int. Dental. J.- 1992.- V. 42, N. (Suppl. 2).- P. 291-304. 21. Соловьева А. М. pH зубной бляшки и роль слюны в ее нормализации // Новое в стоматологии.- 2000.- № 4.- 88-94 с. 22. Теппермен Дж., Теппермен Х. Физиология обмена веществ и эндокринной системы. Вводный курс: Пер. с англ.- М.: Мир, 1989.- 656с. 23. Терапевтическая стоматология: Учебник для студентов медицинских вузов/ Под ред. Е.В.Боровского.- М.: Медицинское информационное агенство», 2003.– 840с. 24. Турбина Л.Г. Хронический генерализованный пародонтит: психонейроэндокринные аспекты // Проблемы нейростоматологии и стоматологии. - 1997. - № 1. - С. 33-38. 25. Храмов В. А., Гаврикова Л. М. Определение уреолитической и гликолитической активности ротовой жидкости человека // Стоматология.- 1996.- № 3.- 7-9 с. 26. Шицкова А.П. Метаболизм кальция и его роль в питании детей. - М.: Медицина, 1984. - 112с. 27. Явербаум П.М., Васильев В.Г. Биохимия соединительной ткани, кости, зуба и слюны.- Иркутск: ИГМИ, 1992.- 29 с. Приложение
|