Влияние питания.
Значение введения кальция и магния в костеобразовании общеизвестно. Недостаточное белковое питание вызывает уменьшение образования мукопротеидов, что ведет к нарушению процесса костеобразования. Многие витамины влияют различным образом на костеобразование. При недостаточном поступлении в организм витамина А тормозится деятельность остеобластов и уменьшается включение S35 и Р32 в состав костной ткани. Недостаток аскорбиновой кислоты ведет к полному прекращению пролиферации остеобластов и тем самым к уменьшению образования органического основного вещества. Падает содержание щелочной фосфатазы. Недостаток витамина Д приводит к рахиту.
Глава 3 Биохимия тканей зуба. Известно, что в построении зуба принимает участие три вида плотных тканей: эмаль, дентин и цемент. Эти ткани в зубе имеют различную локализацию. Кроме того, имеется зубная пульпа, похожая на костный мозг. Эти составные части отличаются друг от друга своим химическим составом (см. таблицы № 2.1, 2.2, 3.1) и гистологическим строением. Существует значительная разница между молочными и постоянными зубами. Химический состав Эмали. Таблица 3.1 Химический состав эмали и дентина (в процентах от сухой массы).
Эмаль составляет до 20—25% зубной ткани и расположена только в области коронки зуба. Эмаль представляет собой самую плотную субстанцию и образует кристаллическую плотную структуру. По сравнению с другими тканями зуба эмаль содержит ничтожное количество воды и органического вещества. В качестве минеральной составной части зуба служат кристаллы гидроксилапатита размером 400-1600 А, которые располагаются тонкими пучками и проходят параллельно или под острым углом к общей оси. Такие пучки, похожие на призму, образуют своеобразные микрокристаллы. Органическое основное вещество эмали содержит особые белки – амелогенин и энамелин. В эмали находят также цитрат (0,1%). Эмаль образуется специфическими клетками адамантобластами (амелобластами), которые встречаются в органической матрице в виде перышек. Состав эмали различен. Эмаль коренных зубов отличается большой плотностью и содержит соответственно меньше азота, чем эмаль резцов. Эмаль молочных зубов содержит много азота и не отличается другими особенностями. Отложение минеральных веществ начинается вдоль амелодентинального соединения. Повышение содержания минералов сопровождается снижением количества воды и белка. Структура минеральных компонентов эмали. «Биологическими» минералами тканей зуба, как и кости являются апатиты Са10 (РО4)6Х2, где Х представлен анионами ОН- (гидроксиапатит - ГАП) или F- (фторапатит -ФАП). ФАП - чрезвычайно распространенный в природе материал, однако в минеральной фазе твёрдых тканей встречается в малом количестве (<0,7%), ГАП - весьма редко встречаемый в неживой природе, в биологических объектах является главным компонентом минеральной фазы твёрдых тканей (≈ 75%). Идеальный, или модельный ГАП образует кристаллы в виде гексагональных призм, значительно различающихся между собой по размерам (в 200 раз) в эмали и дентине. Каждый кристалл ГАП покрыт водной оболочкой (гидратный слой) толщиной ~ 1 нм. Сами кристаллы отделены друг от друга пространством ≈ в 2,5 нм. Строгого соответствия между гексагональными призмами разных кристаллов нет, из-за включения в апатиты других ионов: фторида, хлорида, карбоната, магния и др. Они нарушают жесткое соответствие пространственных размеров, определяемое ионными радиусами между ионами ГАП и вышеуказанными ионами, встраивающимися в ионную решетку в ходе реакций обмена. Обмен ионов в ионной решетке ГАП. Так как замещающие ионы никогда не совпадают по всем параметрам с замещаемыми принято говорить о несовершенном изоморфизме или «изоморфном замещении». Наиболее часто встречаются следующие варианты обмена ионов: 1. Са2+ замещается катионами Sг2+, Ва2+, Мо2+, реже Мg2+, РЬ2+ Катионы Са2+ поверхностного слоя кристаллов, могут на короткое время замещаться катионами К+, Nа+. 2. (Р043-) обменивается с (НРО42-), (СО32-). В поверхностный слой кристалла вместо фосфат-аниона может войти цитрат. 3. (ОН-) замещается анионами галогенов (Сl-, F-, I-, Вг-). Реакции внутрикристаллического обмена ионов протекают очень медленно и условно подразделены на 3 стадии: На I стадии - осуществляется обмен ионов междуокружающей биологической жидкостью и гидратной оболочкой кристаллов. Некоторые ионы (К+, Сl-) только заходят в гидратный слой и легко его покидают, чаще всего не проникая в кристаллы. Другие ионы (Na+ , F-) также легко проходят в гидратную оболочку и, не задерживаясь, проникают в поверхностные слои кристалла. Продолжительность первой стадии - несколько минут, механизм – простая диффузия. II стадия - обмен между ионами гидратного слоя и поверхностью кристаллов ГАП. Ионы гидратного слоя способствуют изменению заряда, приводя поверхность кристаллов в уравновешенное состояние. В поверхность кристаллов в течение несколько часов проникают ионы Са2+, Р043-, СО32-, Sг2+, F-- и др. На III стадии происходит внедрение ионов с поверхности кристаллов вглубь ионной решетки, продолжительность процесса - от нескольких дней до нескольких месяцев. Во внутреннюю часть кристалла проникают немногие ионы: Са2+, Р04 3-, СОз2-, Sг2+, F--. Решающими факторами скорости и масштаба обмена ионов являются концентрации ионов, ионный радиус и продолжительность взаимодействия ионов. Обмен ионов, протекающий в живом организме, в ионной решетке ГАП изменяет его свойства, в том числе, прочность, и существенно влияет на рост кристаллов. Так, замещение Са2+ на Мg2+: Са10(Р04)6(ОН)2 + Мg2+ → Са9 Мg(Р04)6(ОН)2 + Са2+ характеризуется уменьшением молярного соотношения Са/Р, снижением резистентности кристаллов к неблагоприятным воздействиям физического и химического характера. Аналогичное изменение молярного коэффициента Са/Р и свойств ГАП возникает при вытеснении Са2+ ионами Sг2+. Са10(Р04)6(ОН)2 + Sг2+ →Са9 Sr(Р04)6(ОН)2 + Са2+ В кислой среде ионы Са2+ начинают замещаться катионами H+ по схеме: Са10(Р04)6(ОН)2 + 2H+ →Са9 2H+(Р04)6(ОН)2 + Са2+ Так как ионы Н+ во много раз меньше катиона Са2+ замещение настолько несовершенно, что кристалл ГАП разрушается. Са9 2H+(Р04)6(ОН)2 + 6Н+ → 9Са2+ +6HР042-- + 2Н2О. Видно, что во всех случаях нарушаются прочностные характеристики кристаллов и, соответственно, минерализованных тканей. Так в регионах, где вода и почва, а следовательно пища, богаты Sг наблюдаются патологические переломы костей у людей и животных. Хрупкость кристаллов возрастает и при замене фосфат-аниона апатитов. Чаще всего они замещаются ионами НСО3- по схеме: Са10(Р04)6(ОН)2 + 3 НСО3- → Са10(Р04)4 (СОз)3(ОН)2 + 3Н+ + 2РО43-- Интенсивность процесса зависит от общего числа бикарбонатов в организме. Анионы НСО3- образуются за счет взаимодействия СО2, получаемого в реакциях декарбоксилирования, и Н2О. Реакция катализируется карбоангидразой (КА). С02+Н20 → Н2СО3→ Н++ НСО3- Из рисунка видно, что общее количество НСО3-, и, следовательно, вероятность формирования карбонатапатитов зависит от пищевого рациона и интенсивности стрессовых перегрузок. С возрастом количество карбонатапатитов увеличивается.
Карбонатапатиты эмали имеют двойственное происхождение. В непосредственной близости от эмалеводентинной границы они образуются за счет общего пула НСО3- и за счет продукции НСО3- одонтобластами, в которых, благодаря архитектоники дентина, достаточноО2 для активных аэробных процессов, основных поставщиков СО2. В поверхностных слоях эмали карбонатапатиты образуются за счет деятельности микрофлоры зубного камня, которая создает большие количества НСО3-. В результате в этих участках [НСО3-] настолько превышает, [PO43-], что возможен процесс замещения. Накопление карбонатапатита свыше 3-4% от общей массы ГАП снижает кариесрезистентность эмали. Поверхностное замещение Р043- на ионы АsО3- или НАlO32- также приводят к дестабилизации ГАП (например при использовании препаратов Аs и А1, аллюминиевой посуды, экологических аномалиях). Следовательно реакции замещения Са2+ или Р043- другими ионами, как естественными для живой природы, так и чуждыми ей, неблагоприятно влияют на ГАП как путем дестабилизации его структуры, так и в последующем, путем нарушения направленного роста кристаллов (эпитаксии) ГАП в минерализованных тканях. Реакции изоморфного замещения значительно интенсифицируются при состоянии дефицита в организме Са2+ и Р043--, который возникает при недостаточном поступлении этих соединений с пищей или из-за нарушения их всасывания в тонком кишечнике. Наоборот, под влиянием рационов, обогащенных солями кальция, повышается выведение из организма антагонистов Са2+, в частности, Sг2+. Следует подчеркнуть, что возможность вытеснения изоморфного иона в кристаллической решетке ГАП кальцием или занятие последним вакантных мест за счет повышения концентрации Са2+ в окружающей среде, используется для разработки и проведения реминерализующей терапии эмали. Реминерализация предусматривает занятие вакантных мест в ионной решетке ГАП или вытеснение из нее изоморфных ионов повышенными концентрациями Са2+ содержащими в реминерализующих растворах. Процесс реминерализации протекает длительно и многостадийно, что объясняется особенностями динамики внутрикристаллического обмена ионов. Еще одна разновидность реакций замещения: НО- на F- и образование гидроксифторапатитов или фторапатитов. Са10(Р04)6(ОН)2 + 2 F- → Са10(Р04)4 (СОз)3(F-)2 + 2 ОН -
Реакции замещения повышают резистентность ГАП к растворению в кислой среде. Подчеркивается, что при замещении F- даже одной НО- группы, из 50 теоретически возможных, происходит резкое снижение растворимости ГАП эмали кислотами. Указанная особенность гидроксифторапатита и фторапатита рассматривается как ведущий фактор в лактическом действии F- в отношении кариеса. Таким образом, изоморфного замещения НО- в ионной решетке ГАП фтором, т.е фторирование, оказывает защитный эффект, способствуя формированию кристаллов ГАП, за счет усиления преципитации и увеличения их размеров. Важно, что положительное действие оказывают только низкие концентрации фтора. При действии высоких концентраций F-- на ГАП, реакция протекает иначе, и формируется малорастворимый фторид кальция (флюорид),который быстро исчезает с поверхности зубов (эмали) при значении рН среды > 7. Заболевание зубов и костей, развивающееся при избыточной концентрации F воде и почве и сопровождающееся разрушением ГАП называется флюороз. Макро- и микроэлементы в твердых тканях зуба. Преобладающим минеральным компонентом твердых тканей зхуба являются кристаллы гидроксиапатита (≥ 75%). Содержание остальных апатитов колеблется от долей %, до нескольких процентов (табл. 3.2) и зависит от многих факторов. Наиболее выраженные особенности минерального состава твердых тканей, выявленные методом рентгенодифракционного анализа, заключаются в следующем: а) молярное соотношение Са/Р в минерализованных тканях вариабельно и колеблется в диапазоне между 1,5 и 1,7; в наибольшей степени - в эмали; б) некоторая часть Са2+ Р043- и СОз2- находится в аморфном состоянии в виде: восьмикальциевого фосфата пентагидрата – Са8Н2 (РО4)6 • 5Н2О, кальция гидрофосфата дигидрата (брушита) - СаНР04 • 2Н2О; кальция гидрокарбоната Са(НСОз)2. Внутри ионной решетки апатитов могут кратковременно возникать вакантные места. В результате нарушаются соотношения зарядов «+» и «-» в кристалле. Образование вакансий приводит практически к моментальной абсорбции на кристалле соответствующих ионов. Так как разнообразие ионов в живых организмах велико, то в минерализованных тканях в поверхностном слое апатитов встречаются ионы, отсутствующие в модельных ГАП: СОз2-, Mg2+, К+, Сl-, F- и ионы микроэлементов. Причины возникновения вакантных мест: · Промежуточный этап формирования кристаллов. · Вымывание ионов из сформированных кристаллов (Н+→ Са2+). Таблица 3.2 Количественный состав микроэлементов в минерализованных тканях:
* - микроэлементы, концентрация которых в твердых тканях < 100 мг/г: Аg, А1, Аs, Au, Cd, Мn, Sе, Тi, V, W. ** - в гликозаминогликанах. Апатиты минерализованных тканей обладают огромной суммарной поверхностью, что позволяет им сорбировать не только заряженные частицы, но и электронейтральные молекулы. В эмали, по сравнению с другими твердыми тканями, отмечается наиболее высокая концентрация Са2+ и Р043--. Количество почти всех минеральных элементов в этой ткани уменьшается в направлении от поверхности к эмалеводентинной границе. Поверхностный слой эмали, таким образом, является гиперминерализованной зоной с максимальной концентрацией F, достигающей 5 г/кг. Количество фтора жестко коррелирует с его содержанием в питьевой воде. Высокую концентрацию F в поверхностном слое эмали рассматривают как фактор, обеспечивающий ее резистентность к кариесу. В более глубоких слоях эмали концентрация F снижается, но возрастает соотношение Са/Р, поскольку ближе к эмалеводентинной границе возрастает количество карбонатапатитов. Содержание в эмали Mg2+, Na+ и Сl- несколько меньше, чем в дентине, и увеличивается во внутренних слоях эмали. Так, концентрация Mg2+ на границе с дентином почти втрое выше, чем в поверхностном слое. Минеральный компонент эмали отличается от других твердых тканей не только составом элементов, но и размерами и формой кристаллов апатитов. В эмали кристаллы ГАП мельче, имеют игольчатую форму и плотнее упакованы.
Органические компоненты эмали Таблица 3.3 Содержание органических веществ в эмали (в процентах от сухой массы)
Органические вещества распределены в эмали топографически неравномерно. В полностью минерализованном зубе больше всего их содержится в области эмалево-дентинного соединения, в эмалевых веретенах, пучках и полосах Гунтера-Шрегера. Полагают, что межпризменные пространства в сформированной эмали содержат органические вещества, преимущественно белки. После мягкой деминерализации межпризменные пространства остаются в виде сеточки с пустотами на местах деминерализованных призм. Эмалевые призмы на поперечном срезе имеют разную форму: аркадную, овальную, реже гексагональную. Как известно, уникальные свойства любых белков, в том числе инициирующих минерализацию, определяются главным образом количеством и последовательностью определенных аминокислот в полипептидной цепи. Установлены химическая природа и множественность белков эмали. Раньше считали, что белок эмали представлен коллагеном либо кератином, так как он содержит гидроксипролин и имеет Амелогенины и энамелины являются гликофосфопротеинами. Первые содержат 0,6-0,9%сиаловых кислот, 0,2-0,4% галактозамина, 0,12-0,14% глюкозамина, вторые - 2,8-4,7% сиаловых кислот, 1,1% галактозамина, 2,6-3,2% глюкозамина. Фракция амелогенина из матрикса эмали плода содержит около 75% всего органического фосфата, а фракция энамелина – 25%. Эти белки негомогенны. При дальнейшем фракционировании методом электрофореза амелогенин разделяется на 5 фракций с молекулярной массой (округленно) 25, 15, 9,5, 7,5, 6 кДа. Для энамелина установлено, что, очевидно, высокомолекулярные фракции (56, 42, 21 кДа) являются полимерами низкомолекулярных (8 и 13 кДа) фракций. По мере созревания эмали изменяется соотношение между высокомолекулярными и низкомолекулярными фракциями энамелина в результате деградации крупных молекул до более мелких. Кроме амелогенина и энамелина, методом электрофореза в ПААГ выделены из белка эмали плода коровы еще фосфопротеин Е3, состоящий из 46 аминокислот и фосфопротеин Е4, состоящий из 43 аминокислот. У обоих белков молекулярная масса около 5-6 кДа. Аминокислотный спектр этих фосфопротеинов почти не различался. Оба белка содержат по три остатка фосфосерина. Гидроксипролин и гидроксилизин отсутствуют. Неколлагеновые белки эмали участвуют в первичной нуклеации кристаллов гироксиапатита в двух направлениях: во-первых, инициируя минерализацию и, во-вторых, регулируя ее, в частности путем ингибирования инициации минерализации. Механизм кристаллизации эмали заключается в следующем. Сначала происходит первичное связывание ортофосфата гидроксильной группой остатка серина белка эмали. Остатки фосфосерина, образующиеся при этом, обнаружены в амелогенине, энамелине, фосфопротеинах Е3 и Е4. Гидроксил серина фосфорилируется ферментом протеинкиназой за счет Кристаллы гидроксиапатита ориентированы вдоль полипептидных цепей эмали. Такую ориентировку наблюдают в ультраструктурных исследованиях. Вероятно определенная ориентировка кристаллов ГАП по отношению к оси цепи белка вызывается связью кристалла с эмалью несколькими кальциевыми мостиками. Особенностью белка эмали является его способность образовывать комплексы с липидами. P. Prout и соавт. (1976) нашли в эмали 570 мг липидов на 100 г ткани, из которых 1/3 была связана с органической матрицей. Особенностью эмали является связь липидов именно с белковой матрицей, так как значительная часть жиров может быть экстрагирована лишь после предварительной деминерализации эмали. Эмаль - это единственная минерализованная ткань, минерализация которой сопровождается увеличением количества липидов. Липиды в эмали, возможно, находятся в прочной химической связи с ее органическими и минеральными компонентами, выполняя роль «мостиков» между ними. Помимо инициации минерализации белки эмали играют и регулирующую роль, например амелогенин 27 кДа ингибирует осаждение кристаллов ГАП. Для пониманимания молекулярной организации эмали используют классификацию белков, предложенную в работах К.С. Десятниченко в 1974-1977 годах. С помощью электрофореза в полиакриламидном геле, белки эмали разделили на 3 группы: 1. белки, нерастворимые в этилен-диаминтетрауксусной кислоте (ЭДТА) и соляной кислоте (HCl), 2. кальцийсвющие белки эмали (КСБЭ), 3. водорастворимые белки эмали. На основании исследования химического состава и свойств компонентов эмали предложена молекулярно-функциональная модель ее структуры, по которой основой для формирования эмали является белковая матрица. Субъединицы этой структуры представлены Са2+-связывающим белком эмали (КСБЭ) с молекулярной массой 20 000, способным в нейтральной среде образовывать нерастворимый комплекс с Са2+. Причем мономеры белка образуют агрегаты типа ди-, три- и тетрамеров с молекулярной массой 40000 - 80000. Один моль КСБЭ способен связать 8-10 ионов Са2+. В кислой среде комплекс распадается, в результате чего освобождается мономерный белок (КСБЭ). Установлено, что в образовании агрегатов КСБЭ важное значение имеют фосфолипиды, но их роль отличается от роли Са2+. Предполагается, что фосфолипиды играют роль мостика между агрегатом КСБЭ и минеральной фазой, а также принимают участие в образовании комплекса КСБЭ. Исходные водорастворимые субъединицы КСБЭ путем присоединения Са2+ и мультиплицированием связи белок-Са2+-белок образуют нерастворимую в воде белковую матрицу эмали. Таким образом, строится трехмерная сетка эмали, состоящая из субъединиц, соединенных между собой Са2+-мостиками. Связь минерального и белкового компонентов через Са2+ может осуществиться за счет карбоксильных групп остатков аспарагиновой и глутаминовой кислот в белках, что не исключает возможности присоединения Са2+ к фосфату фосфосерила или фосфолипидов. Длина субъединиц КСБЭ, состоящих из 160-180 аминокислотных остатков, около 25 нм. Это примерно соответствует длине основного кристалла эмали - гидроксиапатита. Соизмеримость кристаллов гидроксиапатита и субъединиц КСБЭ создает возможность их широкого связывания. Поскольку молекула КСБЭ эмали может связывать 8-10 ионов Са2+, очевидно, одна часть групп используется на создание белковой трехмерной матричной сетки через Са2+-мостики, а другая - на взаимодействие этой сетки с минеральной фазой - гидроксиапатитом эмали (рис.3.3). Вероятно, связанные с матрицей ионы Са2+ служат точками нуклеации, а в даль
нейшем - зонами роста кристаллов гидроксиапатита. которые ориентируются в соответствии с формирующейся белковой сетью - матрицей эмали. Это обеспечивает их строго упорядоченное расположение, регулярность строения, прочность и другие свойства эмали. Расчеты показывают, что КСБЭ может связывать не более 2,5-5% минеральных веществ эмали. Остальная часть минеральных веществ непосредственно не связана с белками, но ее формирование, ориентация и расположение в эмали уже запрограммированы белковой матрицей и связанными с ней кристаллами гидроксиапатита. Важное значение придают и белку, не растворимому в ЭДТА и НСl. Это очень устойчивый белок, не растворимый даже в 1н НС1. Высокая устойчивость, роднящая его с коллагеном и эластином, позволяет предположить, что он выполняет роль остова, «скелета», придающего устойчивость всей структуре эмали в целом. В связи с этим в молекулярно-функциональной модели эмали нерастворимому белку отведена роль высокомолекулярного, нерастворимого остова - каркаса, с которым связана трехмерная сетка КСБЭ. соединенная с гидроксиапатитом. Как видно из рис.,нерастворимая трехмерная сетка, образованная путем агрегации субъединиц КСБЭ с помощью Са2+ прикреплена, вероятно, также через Са2+ к мягкому остову –– белку, нерастворимому в ЭДТА и HCl. Белковая матрица непосредственно связана с гидроксиапатитом, кристаллизацию которого она инициирует. Этим достигается упорядоченность и равномерность структуры эмали. Таким образом, белковая матрица выполняет следующие функции: 1. Белок, нерастворимый в ЭДТА и HСl, образует остов - каркас, на котором крепятся КСБЭ. 2. КСБЭ образует трехмерную, нерастворимую в нейтральной среде матрицу для минерализации путем взаимодействия мономеров белка с ионами Са2+ с превращением их в нерастворимую сетку.
3. Функциональные группы КСБЭ (вероятно, фосфат фосфосерина и фосфолипидов, свободный карбоксил аспартата и глутамата, белковосвязанного цитрата, гидрофобные группы фосфолипидов и др.) образуют центры (ядра) нуклеации и кристаллизации. 4. КСБЭ и частично белок, не растворимый в ЭДТА и HCl, ориентируют ход кристаллизации, обеспечивая упорядоченность, регулярность и прочность новообразуемой структуры эмали. Значение белков в эмали до настоящего времени изучено недостаточно. Большинство исследователей отводят им пассивную роль. Однако существует и другое мнение. C. Robinson и соавт. (1981), считают, что, в частности, кариесрезистентность эмали зависит от содержания в ней не только неорганических веществ, но и белка. По их мнению, «белковая сеть», окружающая апатиты, предотвращает контакт кислоты с апатитом и смягчает ее влияние. Так, в ранней стадии развития кариозного процесса (в стадии белого и пигментированного пятна) содержание белка на участке поражения увеличивается в 3-4 раза. Как следует из клинических наблюдений, пигментированное пятно в течение нескольких лет может не превращаться в кариозную полость, хотя здесь отмечается значительное уменьшение содержания кальция и фосфора (при белом пятне эти изменения менее выражены). Это является важным, хотя и косвенным, доказательством роли белка в стабилизации очаговой деминерализации (кариозного процесса). Сведения о химической структуре, свойствах и количестве белков эмали необходимы для понимания механизмов ее созревания, функционирования и нарушений при кариесе, гипоплазии эмали и других видах патологии, а также для разработки рациональной профилактики и терапии этих заболеваний, в том числе реминерализующей.
|


 стресс
¯
гормоны стресса
гликоген печени ® глюкоза аминокислоты белки
¯ ¯
общий путь катаболизма
¯
СО2
карбоангидраза
Н2СО3
Н+ НСО3-
стресс
¯
гормоны стресса
гликоген печени ® глюкоза аминокислоты белки
¯ ¯
общий путь катаболизма
¯
СО2
карбоангидраза
Н2СО3
Н+ НСО3-
 Рис. 3.1Происхождение бикарбонат-анионов в тканях организма
Рис. 3.1Происхождение бикарбонат-анионов в тканях организма
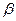 -складчатую структуру. Однако сейчас установлено, что в эмали зуба содержатся специфические белки, преимущественно амелогенин и энамелин
-складчатую структуру. Однако сейчас установлено, что в эмали зуба содержатся специфические белки, преимущественно амелогенин и энамелин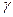 -фосфата АТФ с образованием фосфосерила и АДФ. Затем происходит связывание кальция фосфатом фосфосерина либо карбоксильной группой дикарбоновой аминокислоты. Возможно дальнейшее последовательное присоединение ортофосфата и кальция с образованием первичной молекулы гидроксиапатита и с последующим ростом кристаллов гидроксиапатита по типу эпитаксии без непосредственного взаимодействия с белком.
-фосфата АТФ с образованием фосфосерила и АДФ. Затем происходит связывание кальция фосфатом фосфосерина либо карбоксильной группой дикарбоновой аминокислоты. Возможно дальнейшее последовательное присоединение ортофосфата и кальция с образованием первичной молекулы гидроксиапатита и с последующим ростом кристаллов гидроксиапатита по типу эпитаксии без непосредственного взаимодействия с белком.





