Определение и классификация реакций окисления
В органической химии и технологии процессами окисления считаются превращения веществ под действием тех или иных окислителей. Есть полное или неполное окисление. Под первым понимают сгорание веществ с образованием диоксида углерода и воды:
С3Н8 + 5О2 ® 3СО2 + 4Н2О
В органическом синтезе полное окисление является нежелательным побочным процессом. Для синтеза важны лишь реакции неполного окисления, которые можно разделить на три важные группы: 1. Окисление без разрыва углеродной связи, когда число атомов углерода остается таким же, как и в исходном соединении. Эти реакции делятся на две группы: · окисление по насыщенному атому углерода в парафинах, нафтенах, олефинах, алкилароматических углеводородах и в производных этих соединений, особенно в спиртах и альдегидах:
+0,5О2 +0,5О2
СН3-СН2-СН2-СН3 ® О2 СН3-СН2-СО-СН3 + Н2О
СН2=СН-СН3
С6Н5СН3
· окисление по двойной связи с образованием a-оксидов (эпоксидирование) карбонильных соединений или гликолей:
СН2=СН2 + 0,5О2 ® СН2-СН2О RCH=CH2 + 0,5О2 ® RCOCH3 RCH=CH2 + H2O2 ® RCHOH-CH2OH
2. Деструктивное окисление, протекающее с расщеплением углерод-углеродных связей. К нему способны углеводороды (и их производные) ряда парафинов, нафтенов, олефинов и ароматические углеводороды. Деструкция протекает по связям С-С, С=С или Сар-Сар:
СН3-СН2-СН2-СН3
RCH=CHR¢
CO C
C CO
3. Окисление, сопровождающееся связыванием молекул исходных реагентов (окислительная конденсация или окислительное сочетание): О êê СН2=СН2 + СН3-СООН + 0,5О2 О О êê êê СН2=СН2 + 2СН3-СООН + 0,5О2 2RSH 2RH RCH3 + NH3 (окислительный аммонолиз)
|

 СН3-СН2-СН(ОН)-СН3
СН3-СН2-СН(ОН)-СН3 СН2=СН-СНО + Н2О
СН2=СН-СНО + Н2О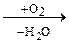 С6Н5СНО
С6Н5СНО  С6Н5СООН
С6Н5СООН
 2СН3-СООН + Н2О
2СН3-СООН + Н2О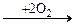 RCOOH + R¢COOH
RCOOH + R¢COOH
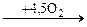 êê O + 2CO2 + 2H2O
êê O + 2CO2 + 2H2O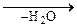 СН2=СН-О-С-СН3
СН2=СН-О-С-СН3 ROOR + H2O
ROOR + H2O


