Окислительные агенты
В промышленности основного органического синтеза используются дешевые окислители и лишь в отдельных случаях применяют агенты, способные к реакциям, не протекающим в присутствии других окислителей.
Молекулярный кислород Важнейший окислительный агент, используется в виде воздуха, технического кислорода, азотнокислых смесей с небольшим содержанием кислорода. Концентрированный кислород оказывает более сильное окисляющее действие, но его применение связано с дополнительными затратами на разделение воздуха. При окислении в газовой фазе, когда смесь азота затрудняет выделение продуктов или их рециркуляцию, используют и технический кислород. Меньшую скорость реакции при окислении воздухом компенсируют повышением температуры или увеличением общего давления, что ведет к росту парциального давления кислорода.
Азотная кислота Азотная кислота (реже оксиды азота) служит вторым по масштабам применения окислительным агентом. Ее действие нередко сопровождается побочным нитрованием органического соединения, усиливающимся с повышением концентрации кислоты. По этой причине для окисления используют 40-60 %-ную азотную кислоту. Азотная кислота как окислитель никогда не применяется для реакций с парафинами. Для нее наиболее типичны реакции деструктивного окисления циклических соединений и веществ с ненасыщенными связями, идущие с участием азотной кислоты, с лучшим выходом, чем при окислении кислородом.
—ОН При окислении азотной кислотой она раскисляется до оксидов азота (NO или N2O3). Экономичность производства во многом зависит от возможности утилизации этих оксидов и регенерации непревращенной азотной кислоты. Первая задача решается окислением оксидов азота воздухом в водном или азотнокислом растворе с образованием азотной кислоты:
N2O3 + O2 + H2O ® 2HNO3 Пероксидные соединения Пероксидные соединения, главным образом пероксид водорода и перуксусная кислота (а в последнее время и гидропероксиды), получили применение как окислительные агенты в основном органическом и нефтехимическом синтезе сравнительно недавно. Ввиду относительной дороговизны их используют только для таких реакций, которые не протекают под влиянием молекулярного кислорода или азотной кислоты. Это относится прежде всего к процессам эпоксидирования ненасыщенных соединений:
-ООН + RCH=CH2 ® -OH + RCH-CH2O
Пероксид водорода обычно применяют в виде 30 %-го водного раствора. Он дает с карбоновыми кислотами соответствующие пероксикислоты по реакции, аналогичной реакции этерификации:
RСООН + Н2О2 «RСОООН + Н2О
Пероксикислоты образуются, кроме того, окислением альдегидов. Так, перуксусная кислота вырабатывается этим путем в промышленном масштабе, а гидропероксиды получают в промышленности окислением углеводородов:
СН3-СНО + О2 ® СН3-СОООН С6Н5-СН(СН3)2 + О2 ® С6Н5-С(СН3)2 ½ ООН
|


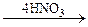 НООС-(СН2)4-СООН + 2N2O3 + 3H2O
НООС-(СН2)4-СООН + 2N2O3 + 3H2O



