Кинетика и катализ реакции радикально-цепного окисления
Гомогенное радикально-цепное окисление состоит из стадий зарождения, продолжения, обрыва и вырожденного разветвления цепи. Первичное образование радикалов при окислении происходит при добавлении в смесь инициаторов (гидропероксиды и пероксиды, 2,2-азо- бис -изобутиронитрил в жидкой фазе: HNO3, NO и HBr в газовой фазе), за счет автоокисления органического вещества или при взаимодействии кислорода с катализатором:
RH + O2 ® R· + HOO· Cо2+ +O2 ® Cо3+-OO·
В развившемся процессе окисления приобретают значение и другие источники радикалов, среди которых важную роль отводят реакциям вырожденного разветвления цепи. При высокотемпературном окислении в газовой фазе оно достигается окислением реакционно-способных альдегидов, а при умеренной температуре жидкофазных процессов – путем разложения гидропероксидов или пероксикислот: RСНО + O2 ® 2RООН ® RО· + RОО· + Н2О
Последняя реакция ускоряется солями металлов переменной валентности (ацетаты и нафтены кобальта, марганца и др.):
RООН + Mn(OAс)2 ® RО· + HOMn(OAс)2 RООOН + Co(OAс)2 ® ROО· + HOCo(OAс)2
Образование радикалов может происходить за счет окисления гидропероксидов, альдегидов или углеводородов валентной формой катализатора:
RООН + Mn3+ ® RОО· + Mn2+ + Н+ RН + Co3+ ® R· + Co2+ + Н+
Стадии продолжения цепи и образования продуктов рассматривались ранее. Обрыв цепи при газофазном окислении обычно протекает линейно при столкновении пероксидного радикала со стенкой:
НОО· ® НООадс
При жидкофазном окислении происходит обрыв на наименее реакционно-способных пероксидных или пероксиацильных радикалах с образованием молекулярных продуктов. Обрыв цепи может происходить на ингибиторах (серосодержащие соединения, фенолы). На практике некаталитическое окисление в жидкой фазе применяют только при синтезе гидропероксидов и пероксикислот:
R· + O2 ROO· + RH 2ROOH ROOH 2ROO·
Для интенсификации начальной стадии окисления выгодно добавлять в исходную смесь готовый гидропероксид. При каталитическом окислении, например альдегидов, кинетику процесса определяют такие элементарные стадии: RСНО + Со3+ ®
RСОOO· + RСНО ® RСООOН + RСООOН + Со2+ ® RСОO· + HO- + Со3+ 2RСОOO· ® молекулярные продукты
Энергия активации при гомогенно-каталитическом окислении углеводородов в жидкой фазе составляет 50-84 кДж/моль по сравнению со 105-147 кДж/моль при термическом или инициированном окислении.
|

 =О + НОО·
=О + НОО·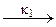 ROO·
ROO· ROOH +R·
ROOH +R·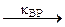 RO· + ROO· + H2O
RO· + ROO· + H2O молекулярные продукты
молекулярные продукты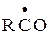 + Со2+ + Н+
+ Со2+ + Н+


