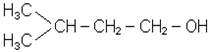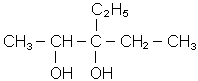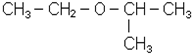Будова, iзомерiя, номенклатура i властивостi. Спирти слiд розглядати як продукти окислення першої стадiї вуглеводнiв або як похiднi вуглеводнiв, в яких один або кiлька водневих атомiв замiщенi на
Спирти слiд розглядати як продукти окислення першої стадiї вуглеводнiв або як похiднi вуглеводнiв, в яких один або кiлька водневих атомiв замiщенi на гiдроксили. Функцiональна група спиртiв ОН-, окси- або гiдроксигрупа, гiдроксил. За кiль-кiстю гiдроксильних груп спирти дiляться на одно- i багатоатомнi, за положенням гiдроксильної групи - на первиннi, вториннi i третиннi - в залежностi вiд того, з яким атомом вуглецю зв’язана ОН-група. Одноатомнi спирти називаються також алкоголятами, двохатомнi - глiколями, трьохатомнi - глiцеринами. Загальна формула одноатомних спиртiв ROH або CnН2n+1OH. Iзомерiя спиртiв залежить вiд iзомерiї вуглецевого ланцюга i положення гiдроксильної групи. Спирти називають: - за радикально-функцiональною номенклатурою, додаючи до назви радикала слово спирт (РН); - беручи за основу метиловий спирт, який ще називають карбiнолом (РН), переважно для вторинних, третинних i розгалужених первинних спиртiв; - за мiжнародною номенклатурою (МН) до назви основного вуглеводню (з замiщувачами, вказаними перед ним), приєднують закінчення “ол” (останній склад слова алкоголь) вказуючи потiм цифрою положення гiдроксилу у вуглецевому ланцю-гу. Для двохатомних спиртiв використовується закiнчення “дiол”, трьохатомних - “трiол” i т.д. Наприклад:
Простi ефiри можна розглядати як продукти замiщення водню в гiдроксильнiй групi спирту на який-небудь радикал. Загальна формула ефiру R-O-R‘. За рацiо-нальною номенклатурою називають радикали простих ефiрiв у порядку ускладнення, до останнього радикалу додають закiнчення “овий” i слово “ефiр”. За міжнародною номенклатурою називають радикали простих ефiрiв у порядку ускладнення, до назви другого радикалу ефiру додають закiнчення “окси”, вiдкидаючи закiнчення радикалiв “-ил”:
Спирти - полярнi сполуки, у метилового спирту m = 5,7× 10-30 Кл×м (1,7Д). Спирти мають дуже слабкi кислi властивостi, слабшi, нiж у води. Вони не забарвлюють лакмус у червоний колiр, практично не взаємодiють з водними розчинами лугiв, однак з лужними металами дають алкоголяти, якi легко розчиняються водою. Спирти можна розглядати i як дуже слабкi основи, тому що вони можуть протонiзуватися за рахунок неподiленої електронної пари атома кисню i, таким чином, утворювати оксонiєвi солi. Практично протонiзацiю з утворенням немiцного оксонiєвого катiона доводиться враховувати як промiжну стадiю реакцiї спиртiв у кислому середовищi. Взагалi спирти можна назвати нейтральними сполуками (особливо на вiдмiну вiд фенолiв, яким ОН-група надає кислого характеру). Для IЧ-спектрiв спиртiв особливо притаманна смуга поглинання при 3300- 2700 см-1 (валентнi коливання ОН-). Крiм того, iснують смуги при 1400-1250 см-1 (де-формацiйнi коливання ОН-) i 1200-1000 см-1 (валентнi коливання С-О). Остання область поглинання спостерiгається i у простих ефiрiв. З хiмiчних властивостей спиртiв найбiльш важлива взаємодiя з лужними металами, спиртами з утворенням простих ефiрiв i кислотами з утворенням складних ефiрiв. Молекули простих ефiрiв також мають деякий невеликий електричний момент диполя (метиловий ефiр m = 4,3 ×10-30 Кл×м; (1,3Д), дiетиловий ефiр - m = 3,9×10-30 Кл ×м (1,18Д), вони iнертнi до рiзних реагентiв, - наприклад, не реагують на холодi з металiчним натрiєм, - i тому часто використовуються як розчинники при проведеннi хiмiчних реакцiй. Простi ефiри можуть все ж розкладатися при звичайнiй температурi під дiєю йодистого алкiлу.
|

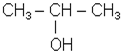 пропанол-2 (МН);
пропанол-2 (МН);