Ми починаємо з вами курс цитології, науки про клітину, з вивчення її хімічної природи.
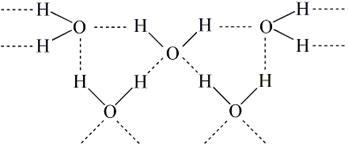
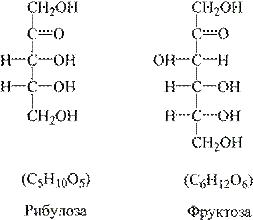
1. Елементарний склад клітини. В клітині виявлено понад 80 елементів, однак відома фізіологічна роль лише 27 з них. Усі елементи можна розділити на 4 групи: 1. Майже 98 % від маси клітин живих організмів припадає на чотири види атомів: Оксиген (O), Гідроген (H), Карбон (C), Нітроген (N). Це органогенні елементи, усі вони входять до складу органічних сполук, про які мова піде нижче. 2. Близько 1,9 % становить сумарна частка восьми макроелементів у живих організмах, причому концентрація окремо кожного з них у клітинах коливається в межах 0,001 – 2 %. До макроелементів належать: Фосфор (P), Калій (K), Сульфур (S), Хлор (Cl), Кальцій (Ca), Магній (Mg), Натрій (Na), Ферум (Fe). 3. Понад 60 хімічних елементів належать до мікроелементів, чий загальний вміст у клітині становить близько 0,01 % від її маси, а концентрація окремого елемента лежить в межах 10-3 – 10-6 %. До найбільш поширених мікроелементів, які відіграють велику роль у різноманітних процесах життєдіяльності, належать: Цинк (Zn), Марганець (Mn), Купрум (Cu), Кобальт (Co), Молібден (Mo), Бор (B), Йод (I), Фтор (F). 4. Концентрація ультрамікроелементів у клітині ще менша, їх загальна частка в живих організмах менше 0,01 %, а концентрація окремих елементів лежить в межах 10-6 - 10-12 %. Лише для деяких елементів цієї групи встановлена їх необхідність для життєдіяльності рослин і тварин (Плюмбум (Pb), Бром (Br), Літій (Li), Алюміній (Al), Силіціум (Si), Олово (Sn), Кадмій (Cd), Селен (Se), Титан (Ti), Ванадій (V), Хром (Cr), Нікель (Ni)). Значення багатьох елементів, яких у мізерній кількості виявлено у складі живих організмів ще не відоме (Аргентум (Ag), Аурум (Au), Гідраргіум (Hg), Цезій (Cs), Вісмут (Bi), Талій (Tl), Цирконій (Zr), Германій (Ge) та ін.). 2. Неорганічні сполуки – вода і мінеральні солі, а також зустрычаються оксиди ы неорганычны кислоти. Вода. Властивості і функції води пов’язані з невеликими розмірами молекулами, її полярністю (Н2О – ковалентний полярний зв’язок), здатністю утворювати водневі зв’язки, а також великою теплоємністю і теплопровідністю. Функції води: розчинник (гідрофільні і гідрофобні сполуки), терморегуляція (замерзає при 0 С0, випаровується при +100 С0), транспорт речовин, участь у заплідненні і розвитку зародка, збереження форми і тиску клітини (явища тургору, осмосу), хімічні реакції гідролізу, фотосинтезу та ін. Мінеральні солі перебувають у клітині у вигляді іонів, серед яких найбільш поширеними є Na+, Ca2+, K+, Mg2+, Cl-, HPO42-, H2PO4-, SO42-, HCO3-. Всередині клітини солі розподілені нерівномірно: натрію більше у ядрі, кальцію в мітохондріях, магнію в рибосомах і хлоропластах. Окремі елементи входять до складу ферментів, вітамінів, гормонів, тощо. Функції: забезпечення біоелектричних явищ (збудження, скорочення, проведення нервового імпульсу), осмотичні явища, регуляторна (у складі ферментів, гормонів), структурна (у складі кісток, черепашок молюсків, тощо), транспортна (перенесення електронів, калієво-натрієвий насос), регуляторна (забезпечення гомеостазу – буферні розчини). 3. Органічні сполуки – вуглеводи, ліпіди, білки, нуклеїнові кислоти. Загальною особливістю усіх органічних сполук є наявність у складі ланцюгів атомів Карбону С-С-С- і відносно велика маса. Вуглеводи. Загальна формула їх складу Сn(H20)m. За хімічним складом – альдегіди або кетони, що містять декілька спиртових груп ОН. Функції вуглеводів: запасаюча, енергетична, структурна (до складу мембран, оболонок, НК). Є моносахариди – солодкі, розчинні (глюкоза, фруктоза, галактоза С6Н12О6, рибоза С5Н10О5, дезоксирибоза С5Н10О4). За кількістю атомів вуглецю серед моносахаридів поширені пентози, гексози, за функціональною групою – альдози і кетози. Прикладами альдоз є пентоза рибоза і гексоза глюкоза:
Прикладами кетоз є пентоза рибулоза і гексоза фруктоза:
Дисахариди С12Н22О11 – солодкі, розчинні, з двох моносахаридів, зв’язок глікозидний (сахароза =фруктоза+глюкоза (цукор буряків і тростини), лактоза =глюкоза+галактоза (молочний цукор), мальтоза =глюкоза+глюкоза (проростки насіння). Полісахариди – нерозчинні, полімери (С6Н10О5)n (целюлоза або клітковина – лінійні ланцюги, крохмаль – запасаюча речовина рослин, з лінійної амілози і розгалуженого амілопектину, глікоген – тваринний крохмаль у печінці і м’язах, розгалужені ланцюги, інулін – резервний вуглевод деяких рослин, (топінамбур, цикорій), розчинний, розгалужені ланцюги, мономер його фруктоза, тому добре при цукровому діабеті!). Сполуки, близькі до полісахаридів: Хітин – близький до целюлози, є 1 група –NH-CO-CH3 замість –ОН (оболонки членистоногих, грибів). Мукополісахариди – містять залишки дисахаридів і аміноцукрів, у складі хряща – хондромукоїд, глікозаміноглікани (містять дисахариди, аміноцукри, в сполучних тканинах). Муреїн – ланцюги полісахаридів із аміноцукрів, зєднані ланцюгами амінокислот (оболонка бактерій). Гліколіпіди =вуглевод+ліпід, глікопротеїни = вуглевод+білок. 4. Ліпіди – гідрофобні, нерозчинні у воді органічні сполуки. Розчиняються в органічних розчинниках – бензолі, ксилолі, хлороформі, бензині, ефірі та ін. Хімічно ліпіди різноманітні: переважно це складні ефіри (гліцерину та інших спиртів з органічними кислотами), стероїди, фосфоліпіди. Функції: енергетична, запасаючу, структурна (клітинні мембрани), джерело води, метаболічна (гормони, вітаміни). Класифікація різноманітна. Прості ліпіди це гліцериди або триацилгліцероли (гліцерин+вищі карбонові кислоти, масла, жири),
стериди (ефіри стеринів – жовчні кислоти, статеві гормони, холестерин, деякі алкалоїди і ефіри рослин, гормони наднирників, вітаміни Д), воски (ефіри вищих одноатомних спиртів, до складу оболонок рослин, комах, соти бджіл). До складних ліпідів належать фосфоліпіди (полярні або амфіпатичні є полярна гідрофільна фосфатна група (головка), у складі мембран), гліколіпіди (полярні, містять вуглевод, у складі нервової тканини – мієлін, мембрани хлоропластів), ліпопротеїди (містять амінокислотні залишки, частіше орнітин, у складі мембран). 5. Білки – полімери, мономерами яких є амінокислоти. Амінокислот у тканинах зустрічається понад 170 видів, але у складі природних білків виявлено 20 альфа-амінокислот, загальна формула
Амінокислоти зв’язані пептидним зв’язком – СО – NH –, послідовно у поліпептидний ланцюг (первинна структура білка). Перший білок, у якому була розшифрована первинна структура – інсулін (10 років, проф. Кембриджа Ф. Свенгер, 2 Нобелівські премії, 51 амінокислота, 2 ланцюга з дисульфідним зв’язком). Первинна структура білка кодується послідовність триплетів нуклеотидів в ДНК (згадуємо генетичний код). Для усіх білків існує вторинна структура (α-спіраль, переважно водневі, дисульфідні зв’язки, 1 виток 3,6 амінокислотних залишків довжина між ними 0,15 нм або β-шар – це витягнуті поліпептидні ланцюги, укладені антипаралельно як складки). Вторинну структуру має білок кератин – шкіра, рогові утвори (α-спіраль), білок шовку фіброїн (β-шар), а білок сполучної тканини колаген має вигляд потрійної спіралі. Третинна структура у вигляді глобул або переплетених фібрил із кількох поліпептидних ланцюгів (водневі, іонні, дисульфідні, гідрофобні взаємодії неполярни молекул). Таку структуру ма більшість білків. У деяких білків кілька глобул з певною просторовою орієнтацією утримуються гідрофобними, іонними, водневими зв’язками - четвертинна структура (гемоглобін, білки вірусів). Часто під впливом фізичних і хімічних чинників білки можуть втрачати просторову структуру (крім первинної) – денатурація, зворотне явище – ренатурація. Часто білки сполучаються з іншими сполуками, утворюючи складні білки – нуклеопротеїди, металопротеїди, ліпо-, гліко, фосфопротеїди. Білки займають 10-20 % маси клітини (50-80 % сухого залишку). Функції білків: каталітична (ферменти), структурна (білки мембран, колаген звязок, кератин волосся), транспортна (через мембрани, альбуміни і глобуліни транспортують іони металів, гемоглобін кисень та вуглекислий газ), енергетична, захисна (антитіла і фібриноген крові, токсичні білки в отрутах тварин), рухова (м’язовий, джгутиковий рух), регуляторна (гормони), сигнальна (рецептори), запасаюча (альбумін яйця, казеїн молока). Ферменти (від латин. fermentum – бродіння) – біологічні каталізатори білкової природи, які утворюються і функціонують у всіх живих організмів і забезпечують узгодженість їх обміну речовин. Відкриття ферментів пов’язане з вивченням процесів бродіння, тому інша назва цих сполук – ензими (від грецьк. е n – всередині, sume – закваска). Подібно до неорганічних каталізаторів, ферменти прискорюють хімічні реакції, не використовуються під час реакції і не входять до складу кінцевих продуктів. Проте для ензимів характерні специфічні особливості, а саме: 1) Переважна більшість ферментів мають білкову природу. Всі вони мають високу хімічну активність; 2) Ферменти мають певний температурний оптимум дії (для більшості ферментів тварин становить 37 - 40°С). 3) Наактивність ферментів впливає реакція середовища. 4) Дія ферментів є специфічною. Це означає, що кожний фермент діє лише на певний субстрат або групу речовин, подібних за будовою; 5) Вони мають дуже високу ефективність за швидкістю та ККД (за 1 секунду фермент може перетворювати мільйони молекул субстрату, при ферментній взаємодії практично не утворюються побічні продукти!);6) Активність ферментів регулюється іншими молекулами — активаторами, що прискорюють їх дію та інгібіторами, які блокують роботу ферментів. Так забезпечується скоординованість ферментних систем організму. Ферменти бувають прості, або однокомпонентні та складні, котрі окрім білковї частини (апоферменту) містять небілковий компонент (кофактор). Просторова конфігурація молекул ферментів є складною. Кожна частина такої молекули спеціалізована. Одна з таких частин є активним центром ферменту, який визначає специфічність хімічної реакції, що каталізується даним ферментом, тобто відповідає за приєднання ферментів до субстрату. Є в молекулі “якірна” площинка, яка приєднує субстрат. Інші частини молекули фермента беруть участь у формуванні і підтримці просторової конфігурації активного центра, визначають внутрішньоклітинну локалізацію фермента, його активних центрів, визначають взаємини з клітинними мембранами тощо. Ферменти забезпечують прискорення перебігу хімічних реакцій внаслідок зниження енергії активації та енергетичного бар’єру прямої реакції. Енергетичний бар’єр – це така кількість енергії, яку необхідно подолати молекулам, щоб відбулася хімічна взаємодія. 6. Нуклеїнові кислоти в клітині 1-2 % (5-8 % сухого залишку) – полімери, мономерами яких є нуклеотиди. До складу нуклеотидів входить азотиста основа (аденін, гуанін – похідні пурину, тимін або урацил, цитозин – похідні піримідину), моносахарид (рибоза або дезоксирибоза), залишок фосфатноїкислоти. Є два основних види нуклеїнових кислот: ДНК і РНК. ДНК – містить спадкову інформацію у вигляді генів, міститься у складі хромосом ядра, а цитоплазматична ДНК всередині пластид і мітохондрій. Первинна структура ДНК складається з нуклеотидів (2000-108 і більше), з’єднаних ефірними зв’язками (між карбоном дезоксирибози і гідроксилом фосфорної кислоти). Вторинна структура ДНК - молекула має вигляд подвійної спіралі, ланцюги якої з’єднані водневими зв’язками за принципом комплементарності А=Т, Г= –Ц), розташовані антипаралельно (модель Уотсона і Кріка, Нобелівська премія). Принцип комплементарності і кількісне співвідношення нуклеотидів пуринових і піримидинових вивчав Е. Чаргафф. Згідно правила Чаргаффа А=Т, Г=Ц, коефіцієнт специфічності К= А+Т/Г+Ц. Сусідні пари нуклеотидів у ДНК знаходяться на відстані 0,34 нм, на 1 виток спіралі припадає 10пар основ, крок спіралі 3,4 нм, діаметр 20 нм, молекулярна маса нуклеотиду в середньому 345 а.о.м. У подвійній спіралі ДНК є великий і малий жолобки, в них розміщуються білки, утворюючи хроматин (нуклеопротеїд). Просторове з’єднання ДНК і білків формує третинну структуру - це так звана суперспіралізація, (молекула схожа на намисто у нуклеосомах, коли спіраль ДНК з’єднується з крупами з 8 гістонових молекул, нанизуючись, як нитка на котушку), в середині мітохондрій і пластид – клубок ДНК. У деяких вірусів 1 ланцюгова ДНК. Подвоєння ДНК відбувається у інтерфазі, називається редуплікація або реплікація. Вона відбувається напівконсервативним способом (1 ланцюг материнський, один новий будується ) (самостійно! – редуплікація ДНК). РНК відрізняється за складом нуклеотидів (азотисті основи А, У, Г, Ц, вуглевод рибоза), структурою – одинарний ланцюг, часто складної конфігурації. Розрізняють кілька видів РНК: - інформаційна і-РНК або матрична м-РНК. Містить генетичну інформацію про послідовність амінокислот, забезпечує процес транскрипції. Розміри 300-3000 нуклеотидів, частка 1-5%, нестабільна, синтезується у ядрі, далі йде до ЕПС, рибосом. - транспортна т-РНК. Міститься у цитоплазмі, забезпечує транспорт амінокислот у місця синтезу білка, частка 10-20 % Розміри 70-90 нуклеотидів, вторинна структура у вигляді листка конюшини, має ділянку антикодон і стебельце приєднання амінокислоти. - рибосомальна р-РНК. Міститься у складі рибосом, частка до 90% усієї РНК, розміри 3000-5000 нуклеотидів. Входить до складу рибосом, - вірусні РНК. Бувають одно- і дволанцюгові, забезпечують спадкову інформацію вірусів. Близькими за хімічним складом до нуклеїнових кислот є аденілові кислоти. За хімічною природою – це вільні нуклеотиди, які у живих клітинах перебувають переважно у вигляді комплексів з йонами Mg2+. Серед них найважливішими є аденозинмонофосфати, аденозиндифосфати і аденозинтрифосфати (АМФ, АДФ і АТФ). Аденілові кислоти відіграють провідну роль в енергетичному обміні організмів. У процесі еволюції клітини виробили здатність синтезувати значну кількість сполук – акумуляторів енергії. Однією з найважливіших таких сполук є аденозинтрифосфатна кислота (АТФ). Це нуклеотид, що складається з аденіну, рибози і трьох залишків фосфорної кислоти, з’єднаних макроергічними зв’язком (40 кДж при розриві 1 моля АТФ). Найбільше АТФ синтезується у мітохондріях. Наочність: Таблиці „Будова ДНК”, „Будова і види РНК”. На самостійне вивчення: 1. Редуплікація ДНК: механізм та етапи. 2. Поняття та властивості генетичного коду.
|



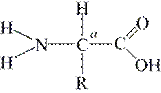 (амінокислоти не протеїнові – орнітин, γ-аміномасляна кислота). Більшість амінокислот синтезується в організмі, але у деякі повинні поступати з їжею тваринного походження – незамінні амінокислоти (триптофан, лізин, лейцин, ізолейцин, фенілаланін, метіонін, треонін, валін).
(амінокислоти не протеїнові – орнітин, γ-аміномасляна кислота). Більшість амінокислот синтезується в організмі, але у деякі повинні поступати з їжею тваринного походження – незамінні амінокислоти (триптофан, лізин, лейцин, ізолейцин, фенілаланін, метіонін, треонін, валін).


