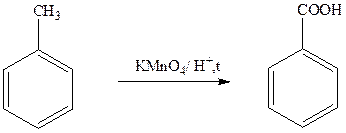АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Арены или ароматические углеводороды – это соединения, молекулы которых содержат бензольные ядра. Эти углеводороды имеют сопряжённую систему двойных связей и практически не вступают в реакции присоединения. Простейшими представителями одноядерных аренов являются: бензол, толуол (метилбензол), о-ксилол (1,2-диметилбензол):
Многоядерные (конденсированные) арены: нафталин С10Н8, антрацен С14Н10:
Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда имеют приятный запах. Однако в настоящее время в понятие "ароматичность" вкладывается совершенно иной смысл. Ароматичность молекулы означает ее повышенную устойчивость в реакциях присоединения, обусловленную делокализацией p-электронов в циклической системе. Для ароматических соединений наиболее характерными являются реакции электрофильного замещения. Можно сформулировать следующие критерии ароматичности: 1. Молекула должна быть циклической и плоской. 2. Содержать циклическую систему сопряжённых двойных связей. 3. Удовлетворять правилу Хюккеля, т.е. содержать 4n+2 p-электронов (где n – 0, 1, 2 … любое натуральное число). По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Делокализация шести p-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Поэтому арены (в отличие от акенов и алкинов) не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Наличие областей повышенной p-электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильными реагентами. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения (SE). Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле С6Н6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на скорость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя. Правила ориентации: 1. Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие. 2. По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода. Ориентанты 1-го рода (орто-пара -ориентанты) направляют последующее замещение преимущественно в орто - и пара -положения. К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках): - CH3 (и другие алкильные группы) (+I); - OH (+M,-I); - OR (+M,-I); - NH2 (+M,-I); - NR2 (+M,-I) +M-эффект в этих группах сильнее, чем -I-эффект. Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто - и пара - положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов. Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом. Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: -F, -Cl, -Br (+M<–I). Являясь орто-пара -ориентантами, они замедляют электрофильное замещение. Причина этого - сильный –I -эффект электроотрицательных атомов галогенов, понижающий p-электронную плотность в кольце. Ориентанты 2-го рода (мета -ориентанты) направляют последующее замещение преимущественно в мета -положение. К ним относятся электроноакцепторные группы: - NO2 (–M, –I); - COOH (–M, –I); - CH=O (–M, –I); - SO3H (–I); - NH3+ (–I); - CCl3 (–I). Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто - и пара -положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета -положении, где электронная плотность несколько выше. Другие реакции (присоединение, окисление) в ароматических углеводородах идут с трудом. Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах: 2С6Н6 + 15 О2 ® 12 СО2 + 6Н2О Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
|