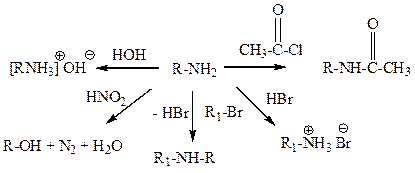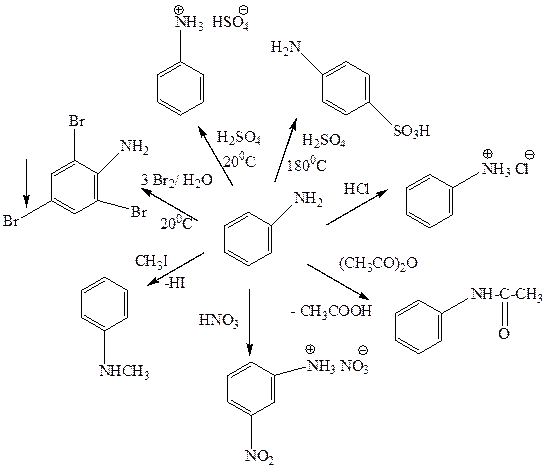ЛАБОРАТОРНАЯ РАБОТА № 4
Опыт 1. Растворимость в воде спиртов и фенолов. а) Налейте в 4 пробирки по 1 мл воды и добавьте: в первую – 0,5 мл этилового спирта, во вторую – 0,5 мл бутилового спирта, в третью – 0,5 мл амилового спирта, в четвертую – 0,5 г фенола, все пробирки встряхните. Пробирку с фенолом сохраните для опытов 3, 5 и 6. Наблюдения и выводы запишите в журнал.
Опыт 2. Получение этилата натрия. В сухую пробирку налейте 1 мл абсолютного этилового спирта и внесите небольшой кусочек натрия (0,1 г). После того, как весь натрий прореагирует, определите рН раствора по универсальному индикатору. Добавьте к раствору этилата натрия 5 капель воды, определите рН раствора. Наблюдения и выводы запишите в журнал.
Опыт 3. Получение глицерата меди. Налейте в пробирку 0,5 мл 2% раствора сернокислой меди и 1 мл 10%-ого раствора едкого натра. При этом образуется студенистый голубой осадок гидроксида меди (II). В эту же пробирку добавьте 4 капли глицерина. Осадок гидроксида меди растворяется, а раствор окрашивается в синий цвет. Затем добавьте 1 мл 20% HCl, окраска исчезает. Это качественная реакция на гликоли и полиолы. Наблюдения и выводы запишите в журнал.
Опыт 4. Получение фенолята натрия. К смеси воды и фенола, из опыта 1 добавьте по каплям 10%-ый раствор едкого натра до полного растворения фенола. Образовавшийся раствор фенолята натрия разделите на две пробирки. В первую пропустите углекислый газ, во вторую добавьте несколько капель разбавленной серной кислоты. Наблюдения и выводы запишите в журнал. Опыт 5. Бромирование фенола. Налейте в пробирку 1 мл раствора фенола в воде, добавьте к нему 1 мл бромной воды, наблюдается выпадение белого осадка. Наблюдения и выводы запишите в журнал.
Опыт 6. Цветные реакции на фенольную группу. а) Поместите с помощью пипетки в пробирку 3 капли раствора фенола в воде (из оп. 1) и добавьте 1 каплю 0,1 н. раствора FeCl3 – появляется фиолетовое окрашивание. Это характерная реакция на фенолы, так как фенолы с FeCl3 дают различные окрашенные комплексы. б) Поместите в пробирку 1 каплю прозрачного раствора фенола в воде (из оп. 1). Добавьте к ней 3 капли 2 н. NH4OH и затем 3 капли насыщенного раствора бромной воды. Через несколько секунд на белом фоне бумаги можно заметить синее окрашивание, постепенно усиливающееся за счет образования красящегося вещества – индофенола. Это чувствительная реакция на фенол называется индофенольная проба. Появление синей окраски обусловлено возникновением в молекуле индофенола характерной хиноидной группировки:
Задачи (спирты, фенолы) 1. Назовите по номенклатуре IUPAC и по рациональной номенклатуре следующие соединения:
2. Напишите формулы изомерных спиртов С5Н11ОН. Назовите их, укажите первичные, вторичные и третичные спирты. 3. Расположите в порядке увеличения кислотных свойств: метанол, фенол, уксусную кислоту, угольную кислоту. Чем обусловлено усиление кислотных свойств фенола по сравнению с aлифатическими спиртами? 4. Напишите реакции изопропилового спирта со следующими реагентами: 1) HBr; 2) PCl5; 3) SOCl2; 4) КMnO4/H2SO4; 5) Na; 6) Mg; 7) Cu (250°C). 5. Получите бутанол-1 из бутилбромида; бутиральдегида; формальдегида и пропилиодида; возможно ли получить этот спирт из бутена-1? 6. В чём заключается кумольный метод получения фенола? Напишите схему этого процесса исходя из бензола. Какие другие методы получения фенола Вам известны? 7. Напишите уравнения реакций анизола с 10%-ой азотной кислотой, бромной водой, ацетилхлоридом (AlCl3), серной кислотой. 8. Какие продукты образуются при действии на бутен-1 раствора перманганата калия в воде при 20°С и перманганата калия в серной кислоте при нагревании. 9. Как в промышленности получают диэтиловый эфир. Почему его называют медицинским? Какой метод Вы можете предложить для синтеза метилэтилового эфира? 10. Какими качественными реакциями можно различить этанол и этандиол; фенол и бензиловый спирт; аллилловый спирт и пропанол? АМИНЫ Амины- производные аммиака, в которых один или несколько атомов водорода замещены на углеводородные радикалы. Амины могут быть предельными, ненасыщенными или ароматическими. По числу радикалов, связанных с азотом, амины делятся на первичные, вторичные и третичные.
Амины обладают основными свойствами, так как атом азота с неподеленной парой электронов способен присоединять протон, например:
Аминогруппа – ориентант I рода, значительно облегчающий протекание электрофильного замещения по ароматическому кольцу. При добавлении к анилину бромной воды образуется белый осадок триброманилина (качественная реакция на ароматические амины).
Реакция с азотистой кислотой позволяют различать первичные, вторичные и третичные амины неароматического характера. При действии азотистой кислоты на первичные алифатические амины (кроме метиламина и ароматических аминов) выделяется свободный азот и образуется спирт, вторичные образуют N-нитрозоамины - желтые осадки или маслянистые жидкости желтого цвета, третичные устойчивы к действию азотистой кислоты (образуют соли азотистой кислоты) при низкой температуре. При нагревании происходит дезалкилирование третичного амина с образованием втор-N-нитрозамина и окислением отщепившегося углеводородного радикала в соответствующий альдегид. (C2H5)2N-C2H5 + HNO2 ® (C2H5)2N-N=O + CH3C(O)H При действии азотистой кислоты в кислых растворах на холоду на анилин и другие ароматические первичные амины образуются соли диазония. Нитрозирование вторичных ароматических аминов протекает по атому азота, а третичных – по ароматическому кольцу с образованием соответствующих нитрозосоединений. Задачи (амины) 1. Назовите следующие соединения по номенклатуре IUPAC.
2. Напишите формулы изомерных аминов состава С5H13N. Укажите первичные, вторичные и третичные амины, назовите их. 3. Получите изопропиламин тремя различными способами. 4. Напишите уравнения реакций взаимодействия этиламина с соляной кислотой, азотистой кислотой, ацетоном, пропионовым ангидридом, избытком бромистого этила и водой. 5. Приведите уравнения реакций взаимодействия метилфениламина с ацетилхлоридом, бромом, серной кислотой (100°С), метилиодидом в присутствии щелочи. 6. Напишите уравнения реакций следующего последовательного превращения: толуол + HNO3/ H2SO4 ® A + Fe/HCl ® Б + С2Н5Br (1 моль) ® В + СH3COCl ® Г 7. Объясните почему водные растворы аминов обладают щелочной реакцией. Почему основность аминов ароматического ряда выражена гораздо слабее, чем основность аминов жирного ряда? Как вы объясните отсутствие основных свойств у амидов (например, у ацетамида)? 8. Какие промежуточные соединения образуются при взаимодействии анилина и бензиламина с раствором нитрита натрия в соляной кислоте при 0°С? Каковы свойства этих соединений? Во что они превращаются при повышении температуры? 9. С помощью каких простых реакций можно различить а) диэтиламин, бутиламин и диметилэтиламин; б) анилин, диметиланилин, триметиланилин. 10. Сравните основность следующих аминов: а) анилин, метиламин, аммиак, диметиламин; б) триизопропиламин, триэтиламин, триметиламин; в) трифениламин, дифениламин, анилин.
|


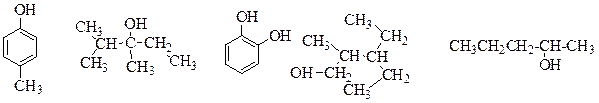


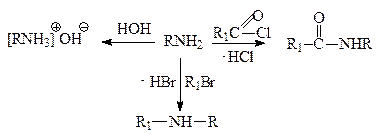 Сила этих органических оснований зависит от электронных эффектов радикалов, связанных с атомом азота. Электродонорные заместители повышают электронную плотность на атоме азота и тем самым облегчают образование донорно-акцепторной связи с протоном за счет неподеленной пары электронов. Электроакцепторные заместители уменьшают электронную плотность на атоме азота, неподеленная пара электронов становится менее доступной для образования связи с протоном. Поэтому предельные амины являются более сильными основаниями, чем аммиак; ароматические амины – слабее, чем аммиак.
Сила этих органических оснований зависит от электронных эффектов радикалов, связанных с атомом азота. Электродонорные заместители повышают электронную плотность на атоме азота и тем самым облегчают образование донорно-акцепторной связи с протоном за счет неподеленной пары электронов. Электроакцепторные заместители уменьшают электронную плотность на атоме азота, неподеленная пара электронов становится менее доступной для образования связи с протоном. Поэтому предельные амины являются более сильными основаниями, чем аммиак; ароматические амины – слабее, чем аммиак.