Химические свойства ароматических углеводородов.
Для аренов мало характерны реакции присоединения, окисляются трудно. Легко протекают реакции замещения водорода в бензольном ядре. I. Реакции замещения. 1. Бензол при обычных условиях не обесцвечивает бромную воду, но в присутствии катализатора – хлорида железа (III) бензол вступает в реакцию замещения – хлорирование:
+ Cl2 → + HCl
В отсутствии катализатора при нагревании или освещении гомологов бензола идёт реакция замещения в боковой цепи: CH3 CH2Cl CHCl2 CCl3
+ Cl2 → → → – HCl – HCl – HCl толуол хлористый хлористый бензотри- бензил бензилиден хлорид 2. Реакция нитрования – протекает в присутствии концентрированной серной кислоты – катализатор и средство отнимающее воду. Смесь азотной и серной кислот называется – нитрующая смесь. NO2
+ HO – NO2 → + H2O
нитробензол Нитробензол – представляет собой светло-жёлтую жидкость, не растворимую в воде, тяжелее воды, ядовит, имеет запах горького миндаля.
Реакции замещения у гомологов бензола протекают легче!!! Например: нитрование или галогенирование: CH3 CH3
+ 3 HO – NO2 → + 3 H2O | NO2 2,4,6-тринитротолуол (тол, тротил – взрывчатое вещество) CH3 CH3
+ 3 Cl2 → + 3 HCl | Cl 2,4,6-трихлортолуол H ↓ H → C ← H
Углерод в метильной группе смещает электронную плотность на себя, на нём возникает частичный отрицательный заряд, который влияет на бензольное ядро. В результате нарушения равновесия в бензольном кольце в положении 2,4,6 электронная плотность увеличивается (+ μ-эффект) и атомы водорода легче подвергаются замещению.
3. Реакция сульфирования. SO2 – OH
+ HO – SO2 – OH → + H2O
бензосульфоновая кислота (сульфобензол)
4. Реакция алкилирования – это введение в бензольное ядро алкильной группы. CH2 – CH3
+ CH3 – CH2 – Cl → + HCl
этилбензол CH2 – CH3
+ СН2 = СН2 →
этилбензол 5. Ацилирование по Фриделю-Крафтцу: O || C – R
+ R – C → + HCl \ Cl арилкетон Хлорангидриды карбоновых кислот реагируют с бензолом.
II. Реакции присоединения (протекают с трудом). 1. Гидрирование протекает в присутствии катализатора (никеля, платины), при нагревании до 2000С и давлении равном 50 атм.
+ 3Н2 D циклогексан
Эта реакция обратима, при нормальном давлении циклогексан вновь переходит в бензол.
2. Хлорирование бензола происходит при освещении реакционной смеси солнечным светом: под влиянием ультрафиолетовых лучей к бензолу присоединяется хлор и образуется гексахлорциклогексан – применяется как инсектицид (вещество применяется для борьбы с вредителями-насекомыми в сельском хозяйстве): Cl
+ 3 Cl2 → / | \ Сl Cl Cl III. Окисление аренов – протекает трудно, в присутствии катализаторов при высокой температуре. Перманганат калия (KMnO4), хромовая смесь (K2Cr2O7 и H2SO4) при обычных условиях не окисляют бензол. При действии окислителей на гомологи бензола окислению подвергаются боковые цепи. Не зависимо от длины боковой цепи всегда образуется бензойная кислота. CH3 CООH
+ 3 [O] → + H2O
CH3 CООK
→ – MnO2, H2O
CH2 – CH2 – CH3 CООH
+ 9 [O] → + 2CO2 + 3H2O
+ 6 [O] → + 2 H2O \ \ CH3 COOH дикарбоновая кислота ортофталиевая кислота CH3 CООН
+ 6 [O] → + 2 H2O
| | CH3 COOH терифталиевая кислота
|

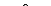 Cl
Cl
 FeCl3 /
FeCl3 /