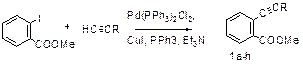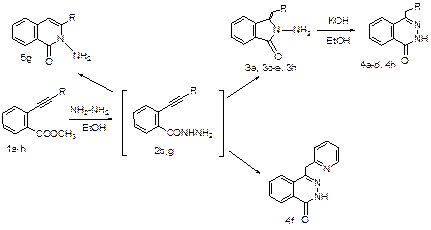ОСНОВНО-КАТАЛИЗИРУЕМАЯ ВНУТРИМОЛЕКУЛЯРНАЯ ЦИКЛОИЗОМЕРИЗАЦИЯ ОТКРЫТЫХ И ЦИКЛИЧЕСКИХ ГИДРАЗИДОВ БЕНЗОЙНЫХ КИСЛОТ
Михайловская Т.Ф.
Учреждение Российской академии наук Институт химической кинетики и горения СО РАН ИХКГ СО РАН, Новосибирск, Россия. Молодой учёный. tanushka8383@mail.ru Научный руководитель: Василевский С.Ф.
Высокий синтетический потенциал полифункциональных арил- и гетарилацетиленов предопределяет неослабевающий интерес химиков к этому классу соединений. Вицинальные функционально замещенные арил- и геарилацетилены являются весьма удобными предшественниками в синтезе конденсированных гетероциклов перспективных биологически активных соединений. С фундаментальной точки зрения они являются удобными моделями для изучения правил гетероциклизации – зависимости направления циклизации от внутренних и внешних условий (структура субстрата, электронные и пространственные параметры). Кроме того, выявление корреляции структура-свойства, их систематизация позволяет осуществить направленный синтез труднодоступных аннелированных гетероциклов. Среди возможных субстратов для изучения этих закономерностей весьма перспективными являются соединения с функциональными группами, имеющими различные по своей природе два и более нуклеофильных центра, которые могут атаковать как α- так и β-атом углерода тройной связи. В качестве такой функции нами выбрана ацилгидразиногруппа, обеспечивающая многоканальность ожидаемых циклизаций. Исходные ацетиленовые соединения были получены преимущественно по реакции Соногаширы – кросс-сочетанием арил(гетарил)галогенидов с терминальными ацетиленами в условиях медно-палладиевого катализа в системе [Pd(PPh3)2Cl2, CuI, Et3N], выходы продуктов составили 65-85%.
В дальнейшем кипячением метилбензоатов 1a-h с избытком гидразин-гидрата в этаноле синтезированы ключевые соединения – ацилгидразины 2b,g с выходами 70-85%. В отдельных случаях уже в условиях получения ацилгидразинов происходила их циклизация с образованием, как 5-, так и 6-членных N-аминолактамов, в зависимости от структуры субстрата.
Неожиданный результат был получен при взаимодействии эфира 1f с гидразином – основным продуктом реакции был соответствующий бензопиридазинон 4f (70%), который формально представляет собой результат атаки α-атома углерода тройной связи «аминным» атомом азота, менее сильным нуклеофилом, чем N –анион, образующийся под действием КОН. Нагревание лактамов 3 с КОН в этиловом спирте приводило к 4-R-бензодиазинонам 4 (43-67%), что представляет собой новый тип перегруппировки. Закономерности, обнаруженные в этой работе, позволяют селективно осуществлять перегруппировку общего предшественника в бензопирролидоны, бензопиридазоны или бензодиазиноны – три перспективных биологически активных класса гетероциклов, обладающих широким спектром фармакологического действия.
Работа выполнена при финансовой поддержке гранта РФФИ №10-03-00257а и Химического Сервисного центра СО РАН. Литература: [1] Михайловская Т.Ф., Василевский С.Ф. Изв. АН., Сер. хим., №3, С.618 (2010).
|