СИНТЕЗ ТРИАЛКИЛОРТОФОРМИАТОВ В ГЕТЕРОФАЗНОЙ СИСТЕМЕ
Паненко С.А.,1 Штамбург В.В.2 1 Национальный технический университет "Харьковский политехнический институт", Харьков, Украина. Аспирант 3г. svetaal@i.ua 2 Национальный технический университет "Харьковский политехнический институт", Харьков, Украина. Молодой учёный. Научный руководитель: Штамбург В.Г.
За последние годы межфазный катализ нашел широкое применение в самых разнообразных областях органического синтеза и прочно вошел в практику промышленного синтеза ряда органических соединений. Катализаторы межфазного переноса используются при проведении реакций в системе, состоящей из двух несмешивающихся фаз: жидкость-жидкость или твердая фаза-жидкость, не исключая и более сложные комбинации из трех фаз типа твердая фаза-жидкость-жидкость. Для успешного применения межфазного катализа принципиально важен правильный выбор катализатора межфазного переноса. В качестве катализаторов в системах жидкость-жидкость используют четвертичные аммониевые, фосфониевые или арсониевые соли, а в системах жидкость-твердая фаза – макроциклические комплексоны: краун-эфиры, криптанды, а также их открытоцепные аналоги – поданды. Целью настоящего исследования является разработка нового способа синтеза триалкилортоформиатов из хлороформа, спирта и щелочи в гетерофазной системе в присутствии катализатора фазового переноса (FTC).
При получения триалкилортоформиатов в качестве катализаторов фазового переноса использовались как краун-эфиры (15-краун-5, 18-краун-6, дибензо-18-краун-6) и липофильные четвертичные аммониевые соли – триэтилбензиламмонийхлорид (ТЭБАХ) и тетрабутиламмонийбромид (ТБАБ), так и поданды 1-3, синтезированные на основе 1,8-дибром-3,6-диоксаоктана:
Использование в качестве катализаторов фазового переноса подандов 1, 2 или краун-эфиров позволило добиться 60-74% выхода триалкилортоформиатов. Выход триалкилортоформиата CH(OR)3 в зависимости от природы FTC приведены в таблице.
СИНТЕЗ ПРОИЗВОДНЫХ 6'-МЕТОКСИ-1'-R-4',4'-ДИМЕТИЛ-4'Н-СПИРО[ЦИКЛОГЕКСАН-1,3'-ИЗОХИНОЛИНА]
Перевощикова А.Н.,1 Рожкова Ю.С.2
1 Интститут технический химии УрО РАН, Пермь, Россия. Аспирант 1г. Cylisa@yandex.ru 2 Интститут технический химии УрО РАН, Пермь, Россия. Молодой учёный. Научный руководитель: Шкляев Ю.В.
Известно, что ретропинаколиновая перегруппировка приводит к изменению скелета молекулы, причем возможна как миграция метильной группы, так и расширение кольца в случае циклических карбинолов [1-3]. Ранее нами показано, что 3,3-диметил-2-(4-метоксифенил)бутан-2-ол при взаимодействии с нитрилами в среде концентрированной серной кислоты дает исключительно 1-замещенные 3,3,4,4-тетраметил-6-метокси-3,4-дигидроизохинолины, а не соответствующие спироциклогексадиеноны [4]. Поведение 1-(4-метоксифенил)-1-(1-метилциклогексил)этанола 1 в данной реакции не изучено. Согласно [1-3] можно ожидать как миграции метильной группы с образованием изохинолина 2, так и расширения циклогексанового кольца в ходе ретропинаколиновой перегруппировки с получением ранее не описанного производного гомофенантридина 3.
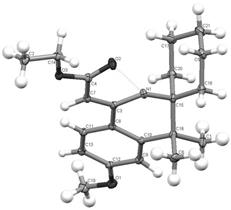
Рис. 1. (Z)-этиловый эфир (2-(6'-метокси-4',4'-диметил-2',4'-дигидро-1'H-спиро[циклогесан-1,3'-изохинолин]-1'-илиден))уксусной кислоты. Работа выполнена при финансовой поддержке грантов РФФИ 10-03-00138 и 11-03-00367. Литература: [1] Вацуро К.В., Мищенко Г.Л.. Именные реакции в органической химии. М. Химия. 1976. С.100. [2] Фьюзон Р.. Реакции органических соединений. М., Мир, 1966, с.172. [3] Abe K. et all, Synthesis, 1984,7,603. [4] Shklyaev Yu.V., Rozhkova Yu.S., Vshivkova T.S., Stryapunina O.G.–Synthesis of the partially hudrogeneted nitrogen-containing heterocycles: how does Ritter-type heterocyclization proceed. - Internacional Congress on Organic Chemistry – Kazan – 2011 – p.122
|



 Действительно, проведение реакции между карбинолом 1 и нитрилами (цианоуксусный эфир, метилтиоцианат, бензонитрил, 3,4-диметоксибензонитрил) привело к получению соединений основного характера с выходом 58-78%, однако на основании спектров ЯМР не удалось установить характер мигрирующей группы. Строение удалось установить методом РСА (рис.1), который показал, что происходит миграция метильной группы с образованием производных 6'-метокси-1'-R-4',4'-диметил-4'H-спиро[циклогексан-1,3'-изохинолина] 2.
Действительно, проведение реакции между карбинолом 1 и нитрилами (цианоуксусный эфир, метилтиоцианат, бензонитрил, 3,4-диметоксибензонитрил) привело к получению соединений основного характера с выходом 58-78%, однако на основании спектров ЯМР не удалось установить характер мигрирующей группы. Строение удалось установить методом РСА (рис.1), который показал, что происходит миграция метильной группы с образованием производных 6'-метокси-1'-R-4',4'-диметил-4'H-спиро[циклогексан-1,3'-изохинолина] 2.