Частота сердечных сокращений в разные возрастные периоды 9 страница
Клетки памяти- это лимфоциты, возвращающиеся в неактивное состояние, но сохраняющие информацию (память) о действовавшем антигене. Они снова поступают в кровь и лимфу и, свободно передвигаясь, как бы «патрулируют» организм. Эффекторные клетки непосредственно участвуют в ликвидации или обезвреживании чужеродного материала. При клеточном иммунитете ими являются цитотоксические Т-лимфоциты (Т-киллеры). Они разрушают чужеродные клетки самостоятельно или посредством выделяемых ими особых веществ-лимфокинов (медиаторов). Гуморальный иммунный ответ определяют В-лимфоциты (бурсазави-симые). При формировании гуморального иммунитета антигенами первично стимулируются также Т-лимфоциты, но при этом образуются Т-хелперы (помощники), выделяющие лимфокины, которые воздействуют на В-лимфоциты и обусловливают их дифференцировку в плазматические клетки, вырабатывающие антитела (белки иммуноглобулиновой фракции крови, способные специфически соединяться с соответствующими антигенами). Следовательно, плазматические клетки являются эффекторными клетками гуморального иммунитета. Одновременно В-лимфоциты получают антигенную информацию от макрофага, захватившего и переработавшего антиген. Таким образом, для осуществления иммунологических реакций необходима кооперация деятельности трех основных типов клеток: Т -, В-лимфоцитов и макрофагов. При антигенной стимуляции образуются также Т-супрессоры, которые блокируют Т-хелперы и поэтому подавляют способность В-лимфоцитов участвовать в выработке антител, т. е. создают иммунологическую толерантность (нечувствительность к определенным антигенам). При повторном попадании данного антигена в организм клетки памяти обеспечивают быстрый и более интенсивный иммунный ответ путем усиленной пролиферации и дифференцировки. Способность к такой усиленной реакции на действовавший антиген сохраняется в течение многих месяцев и даже лет - это одно из проявлений иммунологической памяти. Реакции клеточного иммунитета особенно эффективны против грибов, паразитов, внутриклеточных вирусных инфекций, раковых клеток и чужеродных тканей. Гуморальный иммунный ответ проявляется преимущественно в период внеклеточной фазы бактериальных и вирусных инфекций.
Т,- Т - киллеры; Тх - Т-хелперы; Тс-Т-супрессоры; ПК - плазматические клетки; КМ - костный мозг; СКК - стволовая кроветворная клетка; ВЖ - вилочковая железа; БФ - бурса Фабриция.
Т- и В-клетки обнаруживаются на 10-12-й неделе эмбрионального развития. Способность Т-лимфоцитов к реакциям клеточного иммунитета появляется с 14-15-й недели. Синтез и секреция антител у плода выражены слабо или совсем не определяются, что связано с относительной защищенностью его от внешних стимулов при нормальном течении внутриутробного периода, однако при инфицировании плода способность к продукции антител отмечается с 20-й недели беременности. Содержание Т- и В-клеток у новорожденных выше, чем у детей старшего возраста и взрослых, однако они не обладают достаточной иммунологической компетентностью. Раньше других появляется способность к иммунологическому реагированию на антигены вирусов, стафилококков и жгутиковый антиген сальмонелл. Иммуноглобулины, вырабатываемые В-клетками, разделяются на 5 классов: G, М, A, D, Е. Антитела, синтезирующиеся при внедрении какого-либо антигена, почти всегда принадлежат к разным классам иммуноглобулинов. При первой встрече с антигеном сначала появляются антитела класса IgM, затем IgG, позднее-IgA. При вторичном ответе на данный антиген сразу синтезируются антитела класса IgG. Иммуноглобулины действуют на стафилококки, стрептококки, гемофильную палочку, пневмококки, играют важную роль в раннем блокировании ряда вирусных инфекций (например, ветряной оспы, кори, вирусного гепатита), но они неэффективны при развившихся вирусных заболеваниях. IgG составляют 70-80% всех сывороточных иммуноглобулинов. К ним относится основная часть противовирусных антител, а также антитела против грамположительных бактерий, риккетсий, некоторые антитоксины (стафилококковый, дифтерийный и др.), а также антирезусные гемолизины. Только IgG способен проникать через плаценту, обеспечивая пассивную иммунизацию здорового новорожденного. Уровень его у доношенного ребенка соответствует материнскому. У недоношенного ребенка уровень сывороточного IgG, полученного от матери, значительно ниже, так как трансплацентарный переход его наиболее активен в последние недели беременности. В первые полгода жизни концентрация IgG в сыворотке крови у здоровых доношенных детей постепенно снижается, достигая к 6 - 9 мес минимальных значений, что связано с разрушением материнских иммуноглобулинов, потерю которых не может восполнить собственный уровень синтеза. Затем интенсивность продукции собственных иммуноглобулинов нарастает - к 1 году до 50%, к 4 - 6 годам - до 100% уровня взрослых. IgM составляют 5 - 10% всех сывороточных иммуноглобулинов. К ним относятся антитела против грамотрицательных бактерий, часть противовирусных антител и антитоксинов, гемолизины системы AB0, ревматоидный фактор, аутоантитела и антитела против полисахаридных антигенов. IgM менее специфичны, чем IgG, и очень эффективны в нейтрализации токсических антигенов. Это первая линия защиты, обладающая и такими вспомогательными функциями, как активация комплемента по классическому пути, лизис чужеродных клеток, агглютинация и опсонизация антигенов. В сыворотке крови здорового новорожденного ребенка IgM обнаруживаются в очень низких концентрациях. После рождения уровень их быстро повышается, достигая к 1 - 2 годам концентрации, свойственной взрослым. IgA составляют Юг 15% всех сывороточных иммуноглобулинов. Они синтезируются в плазмоцитах, находящихся главным образом в подсли-зистых тканях, в слизистых оболочках дыхательных путей и кишечника, экскреторных железах. Основная часть IgA остается на слизистых оболочках (секреторные IgA), обеспечивая местную защиту, и лишь небольшое их количество попадает в кровь (сывороточные IgA). В структуре секреторных IgA есть специальный компонент, предохраняющий их от разрушающего действия многочисленных ферментов, находящихся в секретах слизистых оболочек. Секреторные IgA содержатся в слезах, слюне, носовом и бронхиальном секретах, слизистой оболочке кишечника, молозиве. Они обладают выраженной бактерицидностью, опсонирующим эффектом, активируют комплемент по альтернативному пути, стимулируют фагоцитоз. Уровень IgA в секретах у детей первого года жизни низкий, он нарастает медленно и становится наиболее значимым приблизительно к 5 годам. Действие сывороточных IgA слабее, чем секреторных. В сыворотке крови здоровых доношенных новорожденных IgA, как правило, отсутствуют. Их следы появляются с конца первой недели жизни, к 1 году уровень сывороточных IgA составляет 20% от уровня взрослых, а максимальная концентрация достигается только к 10 - 12 годам. IgD и IgE содержатся в сыворотке крови в незначительном количестве (по 0,2%), IgD относятся.к эмбриональному типу глобулинов. Функция их изучена недостаточно. Они способны активировать комплемент по альтернативному пути, нейтрализовывать вирусы. IgE составляют основную часть реагинов-антител, являющихся пусковым механизмом аллергических процессов. Реагины образуются в ответ на попадание в организм аллергена. Они фиксируются на тучных клетках и базофилах, создавая состояние сенсибилизации. Повторное попадание того же аллергена приводит к соединению его с образовавшимися реагинами, что вызывает выброс тучными клетками и базофилами биологически активных веществ, оказывающих как защитное, так и патогенное действие. IgE в сыворотке крови новорожденных практически не определяются. С возрастом их концентрация повышается, достигая уровня взрослых к 10 - 12 годам. Таким образом, развитие иммунной системы является генетически запрограммированным процессом онтогенеза. Процесс созревания ее начинается еще внутриутробно. Наиболее мощный стимул к развитию она получает после рождения, когда значительно увеличивается внешняя и внутренняя антигенная стимуляция, источником которой является в первую очередь желудочно-кишечный тракт, активно заселяемый условно-патогенной микрофлорой уже в первые часы после рождения, а также верхние дыхательные пути, кожные покровы. Возрастная незрелость специфической и неспецифической защиты ребенка первых лет жизни определяет высокую восприимчивость его к различным инфекционным и бактериальным инфекциям, способствует генерализации инфекционного процесса с развитием сепсиса и более тяжелому, чем у детей старшего возраста и взрослых, течению заболеваний. Патологические процессы у детей раннего возраста нередко вызываются кишечной палочкой и стафилококками, т. е. флорой, широко распространенной в быту, к которой имеется определенная невосприимчивость. Наиболее беззащитным оказывается ребенок в возрасте от 6 мес до 1,5 - 2 лет, когда он утрачивает трансплацентарный (пассивный) иммунитет, а собственные иммуноглобулины синтезируются в недостаточном количестве.
МЕТОДИКА ИССЛЕДОВАНИЯ Оценка иммунологического статуса широко используется в клинической практике. Ниже представлены методы ориентировочной оценки клеточного и гуморального иммунитета. Методы ориентировочной оценки клеточного иммунитета (функции Т-клеток): - подсчет лимфоцитов в периферической крови и количества Т - клеток (последние в норме у детей 7 - 14 лет составляют 70% всех лимфоцитов, абсолютное их число равно 1400 кл/мкл). При лимфопении и снижении количества Т-клеток можно предполагать дефицит клеточного иммунитета; - рентгенография грудной клетки в боковой проекции. При отсутствии тени вилочковой железы у ребенка, не подвергавшегося стрессовым воздействиям, можно предполагать гипофункцию железы. Для диагностики тимомегалии по рентгенограмме грудной клетки в прямой проекции рассчитывают кардиотимико-торакальный индекс, представляющий собой отношение ширины сосудистого пучка у бифуркации трахеи к ширине грудной клетки на уровне купола диафрагмы; в норме индекс < 0,33; - внутрикожные тесты на гиперчувствительность замедленного типа. Положительные внутрикожные тесты (например, с туберкулином) обычно свидетельствуют о нормальной функции Т-клеток. При этом отрицательные тесты не являются доказательством Т - клеточной недостаточности, особенно у маленьких детей, поскольку они могут быть не сенсибилизированы к используемым препаратам.
- определение количества В - лимфоцитов в периферической крови (в норме у детей 7 - 14 лет В-клетки составляют 25% всех лимфоцитов, абсолютное число их равно 500 кл/мкл); - определение уровня иммуноглобулинов в сыворотке крови: - суммарной концентрации (норма 10 - 20 г/л); - уровня различных классов иммуноглобулинов (возрастную норму см. в табл. 8); - КТТИ - исследование иммуноглобулинов в различных секретах. При снижении количества В-лимфоцитов и суммарной концентрации иммуноглобулинов можно предполагать дефицит гуморального иммунитета (В-клеточную недостаточность).
Для оценки факторов неспецифической защиты определяют уровни пропердина, лизоцима, интерферона в сыворотке крови, исследуют фагоцитарную систему путем расчета количества лейкоцитов, способных фагоцитировать, их поглотительной активности, микробоцидной способности и др., комплементарную систему (по общей гемолитической активности сыворотки).
СЕМИОТИКА ПОРАЖЕНИЯ ИММУННОЙ СИСТЕМЫ Возможны три типа нарушений функций этой системы: дефект одного из звеньев иммунной системы (первичные и вторичные иммунодефицитные состояния); аутоагрессия против нормальных компонентов организма человека (аутоиммунные заболевания, возникающие вследствие нарушения способности иммунной системы отличать «свое» от «чужого», и иммунокомплекс-ные заболевания избыточное накопление комплексов антиген - антитело); дисфункции, при которых одни звенья иммунной системы гиперплазированы в ущерб функционированию других (реактивный и злокачественный лимфопролиферативные синдромы) (см. в соответствующих разделах II части учебника). Иммунодефицитные состояния развиваются вследствие выпадения или нарушения функции одного или нескольких звеньев иммунной системы. Различают первичные (врожденные) и вторичные (приобретенные) иммунодефицитные состояния. Первичные иммунодефициты делятся на первичное повреждение Т - клеточной системы; первичное повреждение В-клеточной системы; комбинированное повреждение Т- и В - клеточной систем. Суммарная частота наследственных форм иммунодефицитных состояний составляет около 2:1000, среди них 50 - 75% - первичные дефекты В - клеточной системы, 5 - 10% - Т - клеточной системы. Первичная иммунологическая недостаточность может быть результатом генетически обусловленного дефекта на стадии стволовой клетки; ее дифференцировки на Т- и В-лимфоциты; созревания плазматических клеток; кооперации клеток в иммунном ответе или нарушения развития лимфоид-ной системы в онтогенезе. Предположение об иммунодефицитном состоянии у ребенка возникает в следующих случаях: - ребенок страдает рецидивирующими и (или) тяжело протекающими инфекционными заболеваниями (чаще всего бронхолегочной системы, желудочно-кишечного тракта, мочевыводящих путей, кожных покровов) нередко с развитием гнойных осложнений (отитов, синуситов и др.) или сепсиса; - отмечаются необычные реакции на банальные инфекционные агенты (например, гигантоклеточная пневмония при краснухе, пневмония при ветряной оспе); - инфекционное заболевание вызвано необычными микроорганизмами (например, пневмоцистой Карини); - наличие у ребенка необычных реакций (системных) на вакцинацию живыми вирусными вакцинами или БЦЖ; - необъяснимый гематологический дефицит у ребенка (анемия или лейкопения, или тромбоцитопения); - стойкое расстройство пищеварения с развитием синдрома мальабсорбции. У детей с иммунодефицитом чаще развиваются злокачественные новообразования. Точно диагностировать патогенез иммунологической недостаточности по клинической картине сложно, однако можно выделить некоторые клинические проявления, наиболее характерные для данного дефекта. Больным с первичным дефицитом клеточного иммунитета (дефект Т-клеточной системы) свойственна в первую очередь склонность к грибковым (хронические и рецидивирующие кандидозы кожи и слизистых оболочек) и вирусным заболеваниям, а также бактериальным внутриклеточным инфекциям (туберкулез, сальмонеллез и др.). Отсутствие или сниженное количество в крови у этой категории больных Т-клеток сопровождается нарушением их функции. Именно этой группе больных присущи системные реакции в ответ на иммунизацию живыми вирусными вакцинами и БЦЖ. К заболеваниям, обусловленным данной аномалией иммунитета, относится синдром Ди - Джорджи (гипоплазия вилочковой железы), синдром коротконогих карликов (синдром гипоплазии волос и хрящей), хронический слизисто-кожный кандидоз. Больные с первичной недостаточностью гуморального иммунитета особенно чувствительны к тяжелым гнойным бактериальным инфекциям дыхательных путей и кожи. Их вызывает преимущественно условно патогенная микрофлора, постоянно находящаяся на слизистых оболочках и кожных покровах (стафилококки, пневмококки, грамотрицательные бактерии). Чаще всего развиваются пневмонии, реже инфекции кожных покровов, мочевых путей, сепсис, менингит. Отмечена связь этого вида иммунологической недостаточности с аутоиммунными заболеваниями. При этом в сыворотке крови наблюдаются резкое снижение (вплоть до полного отсутствия) всех видов иммуноглобулинов, селективный дефицит одного из классов, повышение уровня одного из классов иммуноглобулинов на фоне падения остальных (дисгаммаглобулинемия) при нормальной суммарной концентрации их в крови. Наиболее тяжело протекает пангипогаммаглобулинемия (врожденная агаммаглобулинемия, которую называют также болезнью Брутона, или синдромом «иммунологического безмолвия»); при этом заболевании дети неспособны вырабатывать иммуноглобулины всех классов. Больные хронически страдают различными формами бактериальных инфекций, являющихся при выраженных иммунных дефектах основной причиной их ранней смерти. Следует отметить, что заболевание начинает проявляться с 6-месячного возраста, когда трансплацентарно переданные иммуноглобулины матери разрушаются. Из селективных дефицитов иммуноглобулинов наиболее часто встречаются дефицит IgA (1:300-700) и дефицит IgM (1:1000). Селективный (избирательный) дефицит IgA или IgA и IgG сопровождается развитием синдрома хронической диареи, не поддающейся коррекции, а дефицит иммуноглобулинов IgM и IgG- предрасположенностью к гнойным инфекциям. Для комбинированной иммунологической недостаточности (дефицит Т- и В-клеточных систем) характерна совокупность клинических проявлений дефицита каждого из звеньев, кроме хронического кандидоза кожи и слизистых оболочек. Вторичные иммунодефициты. Первопричина вторичных иммунодефицитных состояний лежит вне лимфоидной системы. Ряд заболеваний и патологических процессов сопровождается инволюцией лимфоидной ткани, лимфопенией и гипогаммаглобулинемией, что приводит к развитию иммунодефицита. К ним относятся: - патологические процессы, сопровождающиеся потерей белка (иммунологического материала): нефротический синдром, ожоги кожи, экссудативные энтеропатии; - дистрофии, авитаминозы; - многие вирусные (корь, грипп и др.), бактериальные (холера), грибковые (кандидозы) инфекции и гельминтозы; - тяжелые хирургические травмы и послеоперационные осложнения; - некоторые лечебные воздействия (рентгеновское облучение, терапия кортикостероидами и цитостатиками); - опухоли лимфоретикулярной природы (лимфогранулематоз, хронический лимфолейкоз и др.). У детей первых 3 лет жизни иммунодефицитное состояние (Т - клеточная недостаточность) может быть следствием тимомегалии, обусловленной поражением разных звеньев гипоталамо-гипофизарно-надпочечниковой системы, возникающим в результате действия различных этиологических факторов. В стрессовых ситуациях иногда развивается временная, быстрая (акцидентальная) инволюция вилочковой железы, при которой происходит выброс Т-лимфоцитов в кровь, происходит их массовая гибель в самой железе (особенно в корковом веществе), фагоцитоз макрофагами внешне неизмененных лимфоцитов. Вилочковая железа вовлекается в стресс - реакции вместе с надпочечниками. Транзиторная недостаточность гуморального иммунитета свойственна детям первого года жизни после 6-месячного возраста (см. выше) и рассматривается как возрастная физиологическая норма. Первичный дефект (генетически обусловленный) неспецифических факторов защиты включает нарушения в системе комплемента и фагоцитоза. Генетические дефекты системы комплемента могут затрагивать любой из ее компонентов. Дефицит того или иного компонента отменяет следующую за ним цепь реакций в каскадном механизме активации комплемента. Клинически дефицит компонентов комплемента проявляется пониженной резистентностью ребенка к бактериальным инфекциям (Cls С2, С3, С5) или повышенной частотой возникновения болезней гиперчувствительности (Q, С2, С4). Недостаток или отсутствие СиС2, С4, С5 ведет к развитию симптомокомплекса - системной красной волчанки, болезни Шенлейна - Геноха, полимиозита. Отсутствие ингибитора Сх ведет к возникновению рецидивирующих ангионевротических отеков. Больные с нарушенными функциями фагоцитов подвержены рецидивирующим инфекционным заболеваниям, вызванным обычно непатогенными бактериями, которые становятся патогенными в организме хозяина. Примером врожденного дефекта фагоцитарной системы у детей является хронический гранулематоз (синдром парадоксов). Дети, страдающие данным заболеванием, обладают высокой устойчивостью к вирулентным стрептококкам, менингококкам, пневмококкам, но оказываются весьма чувствительны к маловирулентным стафилококкам, кишечной палочке, грибам и другим сапрофитам. Генерализованное поражение всех компонентов иммунной системы (Т- и В-клеток) и неспецифических гуморальных факторов (комплементарной и фагоцитарной систем) характерно для СПИДа.
Глава 20 ЭНДОКРИННАЯ СИСТЕМА
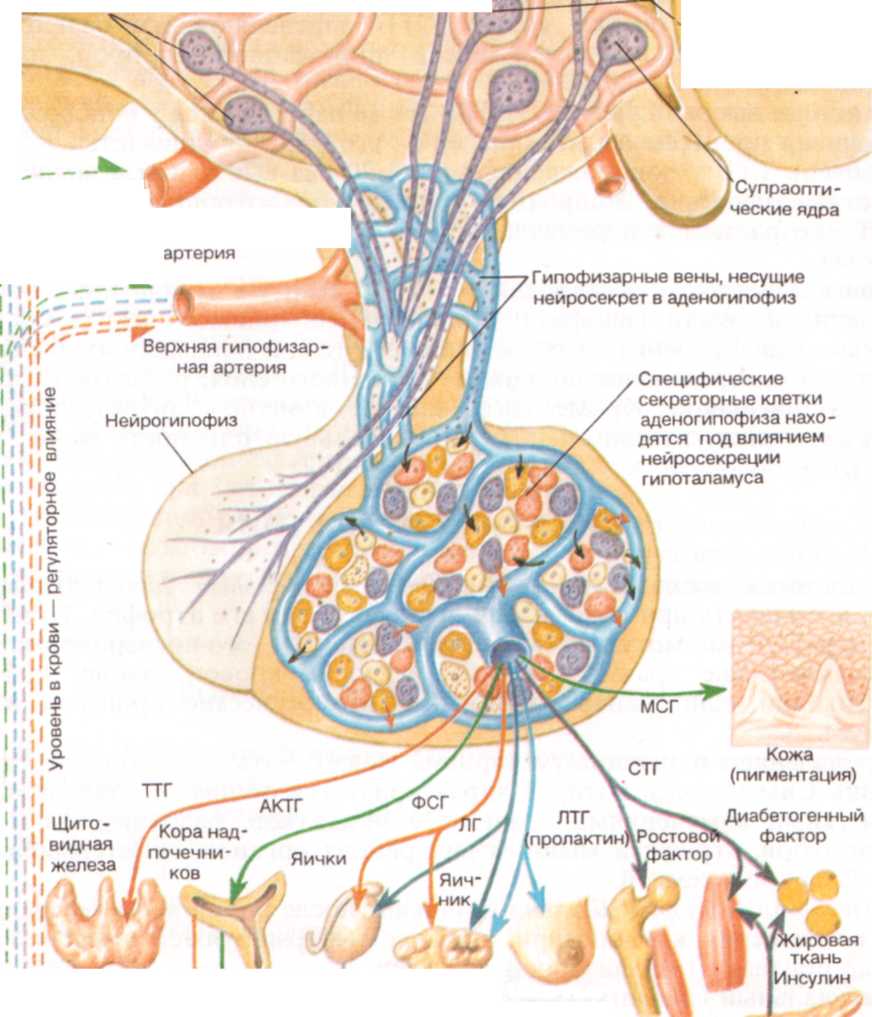
ГИПОФИЗ АНАТОМО - ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ Гипофиз - главная эндокринная железа, от деятельности которой зависят структура и функция других эндокринных желез. Гипофиз расположен в турецком седле, представляющем собой углубление в основании черепа, от полости которого он отграничен складкой твердой мозговой оболочки (диафрагмой турецкого седла). Тонкой ножкой, проникающей через диафрагму, гипофиз связан с гипоталамусом. Гипофиз состоит из трех долей: передней, средней и задней. Передняя и средняя доли имеют эпителиальную природу и объединены названием аденогипофиз. Задняя доля – нейрогипофиз - является выростом мозга и состоит из клеток нейроглии. В аденогипофизе вырабатываются следующие гормоны: соматотропин (соматотропный гормон, СТГ); кортикотропин (адренокортикотроиный гормон, АКТГ); тиреотропин (тиреотропный гормон, ТТГ); лютропин (лютеинизирующий гормон, ЛГ); фоллитропин (фолликулостимулирующий гормон, ФСГ); пролактин (лютеомаммотропный гормон, ПРЛ); меланотропин (меланоцитостимулирующий гормон, МСГ); липотропин (липотропный гормон, ЛТГ). Гипофиз начинает функционировать очень рано: уже с 9 - 10-й недели внутриутробной жизни удается определить следы АКТГ. У новорожденных масса гипофиза равна 10 - 15 мг. К периоду половой зрелости масса гипофиза увеличивается в два раза, достигая 20 - 35 мг, у взрослого гипофиз весит 50 - 65 мг. Соматотропин обладает белково-анаболическим и ростовым действием, стимулирует синтез белка, рост и развитие скелета, активируя хондро-и остеогенез. Кортикотропин способствует пролиферации клеток коры надпочечников, стимулирует биосинтез глюкокортикоидов, андрогенных кортикостероидов и альдостерона. Кроме того, действуя на меланофоры, АКТГ вызывает усиление пигментации кожи. Тиреотропин способствует пролиферации клеток щитовидной железы, стимулирует синтез ее гормонов, их высвобождение из связи с тиреоглобу-лином и секрецию. Лютропин у женщин способствует завершению созревания яйцеклеток, овуляции и образованию желтого тела, у мужчин стимулирует продукцию андрогенов.
Пролактин действует на молочные железы, стимулируя лактацию, у мужчин является фактором роста предстательной железы. Меланотропин стимулирует ферментные системы меланоцитов, вызывает дисперсию пигментных гранул в меланоцитах, что приводит к потемнению кожи. Липотропин оказывает жиромобилизующее действие, стимулирует использование жира в энергетическом обмене. Секреторная активность аденогипофиза находится под контролем гипоталамуса, который синтезирует стимулирующие факторы - либерины и тормозящие - статины. Нейрогипофиз секретирует два гормона - антидиуретический гормон (АДГ, вазопрессин) и окситоцин. Антидиуретический гормон усиливает реабсорбцию воды из мочи в дистальных отделах почечных канальцев и является регулятором водного баланса организма. Окситоцин вызывает сокращение мышцы матки, особенно в процессе родов, и миоэпителиальных клеток молочных желез, влияя на секрецию молока. Основным регулятором синтеза АДГ является осмотическое давление крови. Стимуляция секреции окситоцина происходит при растяжении родовых путей, раздражении наружных половых органов и сосков молочных желез.
[по Жуковскому М. А., 1995]
|

 Органы иммунной системы:
Органы иммунной системы:
 Эндокринная система представляет собой физиологическую систему, объединяющую железы внутренней секреции (эндокринные железы), вырабатывающие и выделяющие в общую циркуляцию особые химические вещества гормоны, роль которых чрезвычайно велика в регуляции всех функций организма и поддержании его гомеостаза.
Эндокринная система представляет собой физиологическую систему, объединяющую железы внутренней секреции (эндокринные железы), вырабатывающие и выделяющие в общую циркуляцию особые химические вещества гормоны, роль которых чрезвычайно велика в регуляции всех функций организма и поддержании его гомеостаза. Фоллитропин в женском организме стимулирует рост и созревание овариальных фолликулов, в мужском - рост и пролиферацию семяобразующих канальцев яичка и сперматогенез.
Фоллитропин в женском организме стимулирует рост и созревание овариальных фолликулов, в мужском - рост и пролиферацию семяобразующих канальцев яичка и сперматогенез.