Химические свойства моносахаридов
Знание химических свойств моносахаридов необходимо для понимания путей превращения этих важнейших биоактивных соединений в организме и участия их в метаболических процессах. 1. цикло-оксотаутомерия(кольчато-цепная таутомерия) и мутаротация 2. изомеризация, эпимеризация 3. образование аминогруппы у атома С 2. 4. образование гликозидов 5. образование сложных эфиров 6. реакции окисления 7. реакции восстановления
9. 4.1. Цикло-оксотаутомерия Моносахариды существуют в форме альдегидов(кетонов) и циклических внутренних Полуацеталей(полукеталей). Присутствие двух групп - карбонильной и гидроксильной - в молекуле моносахарида делает возможным протекание внутримолекулярной реакции нуклеофильного присоединения А N, которая сопровождается образованием циклического полуацеталя (полукеталя). полуацетальный (гликозидный) H Н гидроксил | |
А N изомера ————— О — Н ——— О циклическая форма (полуацеталь) Два процесса приводят к образованию циклического соединения: А) нуклеофильная атака кислорода по атому углерода карбонильной группы Б) атом водорода присоединяется к кислороду карбонильной группы Появляется спиртовая группа вместо карбонильной. Возникают два зеркальных изомера, т.к. возникает новый хиральный центр. Такие зеркальные циклические изомеры называются аномерами. Гидроксильная полуацетальная группа в аномерном центре углевода в циклической форме называется гликозидной, аномерной.
аномерные гидроксигруппы(выделены жирным шрифтом)
Н ОН НО Н
С С
цикл цикл Зеркальная изомерия циклической формы моносахарида Устойчивыми являются пятичленные и шестичленные циклические формы. Пятичленные формы носят название фуранозы (фуранозные циклы) (по аналогии с пятичленным циклическим соединением фураном) Шестичленные циклы носят название пиранозы (пиранозные циклы) Все альдопентозы: рибоза, дезоксирибоза и др. и кетогексоза фруктоза in vivo присутствуют в форме фуранозы(in vitro возможно образование и пиранового цикла). Фуранозный цикл плоский. Альдогексозы глюкоза, галактоза, манноза образуют in vivo шестичленные пирановые циклы (in vitro возможно также образование фуранового цикла) Пиранозный цикл может быть, как и циклогексан, в двух пространственных формах: кресло и ванна. В природных соединениях пиранозные циклы имеют конформацию кресло. Пиранозные циклы более устойчивы к размыканию по сравнению с фуранозными. В циклической и нециклической форме число гидроксильных групп одинаковое, но в циклической форме исчезает карбонильная группа. Вместо нее образуется гидроксильная группа, которую называют полуацетальной (гликозидный гидроксил). Два зеркальных циклических изомера по атому углерода С1 обозначают двумя символами- а- и β;. Два циклических изомера моносахарида, отличающихся только пространственным расположением полуацетального гидроксила, носят название аномеров: а-аномер и Β- аномер. Циклические формы моносахаридов записывают, используя два различных вида структурных формул: Колли- Толленса и Хеуорса. Формулы Колли- Толленса образуются из проекций Фишера, в настоящее время они применяются крайне редко, но зато поясняют, как происходит циклизация. От формулы Колли-Толленса зная особые правила, легко перейти к формуле Хеуорса.
Цикло –оксотаутомерия гексоз. Глюкоза
| | | Н -2C- ОН Н -C- ОН Н -C- ОН | | |
| | | Н -4C- ОН Н -C- ОН Н -C- ОН | | |
СН2 ОН СН2 ОН СН2 ОН А Б β- аномер схема а-аномер β – D- глюкопираноза циклизации а- D -глюкопираноза Атом кислорода гидроксильной группы у С5 нуклеофильно атакует атом углерода карбонильной группы, атом водорода этой гидроксильной группы переходит к атому кислорода карбонильной группы – замыкается цикл(атом кислорода атома С5 рисуют в середине цикла) У атома С1 возникает гидроксильная группа- полуацетальный, гликозидный гидроксил. (на схеме формулы А и Б, гидроксильная группа выделена жирным шрифтом) В циклических формах атом С1 тетраэдрический, связан с четырьмя разными группировками, возникает новый хиральный центр, который обусловливает существование двух изомеров- а- и β-аномеров. Атом С1 принято называть «аномерным» Аномер, в котором полуацетальный гидроксил расположен также, как гидроксильная группа, определяющая стереоряд (справа от оси молекулы), является а-аномером; если полуацетальный гидроксил расположен по другую сторону (слева) - β-аномер. Для построения формул Хеуорса следует нарисовать шестичленный цикл, поставить циклический атом кислорода в определенном месте(правый верхний угол, это положение не нумеруется), нарисовать вертикальные связи у каждого атома углерода и те группы, которые в формуле Колли-Толленса были справа(d- конфигурация) написать под плоскостью цикла, а те, что были слева (l- конфигурация) написать над плоскостью цикла. Упрощенное правило: что справа -то внизу, что слева – то вверху (удобно запомнить, в каждой паре двух слов одна буква «р»). На рисунке изображена а –D - глюкопираноза (формула Хеуорса)
l d гидроксил в а-форме направлен «вниз»
На следующем рисунке представлены оксоформа D-галактозы и циклоформа: а –D глюкопираноза.(внимательно рассмотрите и сравните расположение всех гидроксигрупп в обеих формулах и гликозидного гидроксила)
D – галактоза (d l l d) l d гидроксил а- D- галактопираноза
Цикло –оксотаутомерия пентоз и кетогексоз Альдопентозы и кетогексозы в биологических соединениях образуют фуранозные пятичленные циклы. Все ранее отмеченные особенности и правила записи формулы Хеурса сохраняются.
D- фруктоза (d d l) d l гидроксил β - D- фруктофураноза
В растворе рибоза существует в четырех формах: - пиранозных и фуранозных. Доля менее устойчивых фуранозных форм ниже 25%, но во всех природных соединениях: нуклеотидах, нуклеиновых кислотах, АТФ, рибоза и дезоксирибоза находятся только в β - аномерной фуранозной форме, что увеличивает внутренний запас энергии соединения и его реакционную способность.
Мутаротация (изменение вращения) В растворах устанавливается равновесие между всеми возможными формами: оксо и циклическими (а и β). Кристаллическая глюкоза а-D- глюкопираноза имеет коэффициент удельного вращения [ а ] =1120, а у кристаллической β- D- глюкопиранозы [ а ] =190. В растворе каждый из аномеров превращается в другой и устанавливается равновесная смесь обоих аномеров [ а ] = 530 До наступления равновесия значение [ а ] изменяется, это явление получило название мутаротации а-аномер <—> оксоформа <—> β-аномер около 36 % 0,02% около 64% β-Аномерная форма более устойчива, т.к. гликозидный гидроксил может образовать водородную связь с атомом кислорода в пиранозном цикле.
Н Альдозы в циклической форме сохраняют свойства карбонильных соединений, в том числе качественные реакции, позволяющие обнаружить присутствие альдегидной группы.
9.4. 3. Фосфорные эфиры Все моносахариды в клетке существуют в виде фосфорных эфиров, которые образуются в ферментативных реакциях с участием АТФ
Рибоза + АТФ ———> рибозо -5- фосфат Глюкоза + АТФ ———> глюкозо -6- фосфат Галактоза + АТФ ———> галактозо -6- фосфат Возможен перенос фосфатной группы из одного положения в другое в обратимой реакции изомеризации Глюкозо-6-ф <———> Глюкозо-1-ф (аномеры а и β;)
Фосфорные эфиры гидролизуются in vitro и in vivo Глюкозо-6-фосфат + Н2О ———> глюкоза + Н3 РО4
|






 d
d 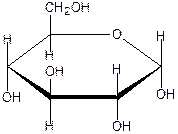 полуацетальный
полуацетальный d
d 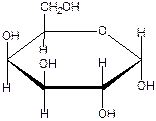 полуацетальный
полуацетальный
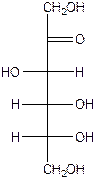
 β - полуацетальный
β - полуацетальный ———О
———О


