ИССЛЕДОВАНИЕ ТЕМПЕРАТУРНОЙ ЗАВИСИМОСТИ ТЕРМОДИНАМИЧЕСКИХ ФУНКЦИЙ НА ПРИМЕРЕ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
Теплота нейтрализации Рассмотрим реакцию нейтрализации сильной кислоты сильным основанием, например нейтрализацию соляной кислоты раствором едкого калия. Оба компонента полностью диссоциированы, поэтому уравнение нейтрализации HCl + KOH = KCl + H2O можно написать и ионной форме: H+ + Cl– + K+ + OH– = K+ + Cl– + H2O или H+ + OH– = H2O. (2.94) Таким образом, в случае нейтрализации сильной кислоты сильным основанием, независимо от природы аниона кислоты и катиона основания, протекает один и тот же процесс – образование молекул воды из водородных и гидроксильных ионов. Понятно, что одному и тому же процессу соответствует один и тот же тепловой эффект, значение которого в разбавленных растворах при 25°С, согласно первому следствию закона Гесса, рассчитывается следующим образом:
Стоит отметить, что в растворе кислоты свободных протонов Н+ нет, из Н+ и Н2О образуется ион гидроксония: H+ + H2O = H3O+, поэтому более правильной записью уравнения (2.94) будет следующая: H3O+ + OH– = 2H2O. Иначе протекает процесс, когда либо кислота, либо основание, либо оба компонента являются слабыми электролитами. Рассмотрим пример нейтрализации уксусной кислота раствором КОН. Процесс можно представить в виде следующих последовательных стадий: 1. Диссоциация – распад молекул слабой кислоты на ионы
2. Гидратация ионов
H+ + H2O = H3O+. 3. Взаимодействие гидратированных ионов с образованием молекул воды H3O+ + OH– = 2H2O. В упрощенном виде описанный процесс можно представить следующим образом:
Таким образом, тепловой эффект процесса нейтрализации слабой кислоты
Кроме того, при более точных расчетах теплоты нейтрализации нужно учитывать, что при сливании растворов кислоты и основания происходит изменение объёмов как кислоты, так и основания, т. е. нужно учитывать еще две промежуточные теплоты разбавления. С учетом вышесказанного, выражения для теплоты нейтрализации будут иметь следующий вид: – для реакций нейтрализации сильной кислоты сильным основанием
– для реакций нейтрализации слабой кислоты сильным основанием
где
где
|





 является суммой теплового эффекта диссоциации молекул слабой кислоты
является суммой теплового эффекта диссоциации молекул слабой кислоты  , теплового эффекта образования гидратированных ионов слабой кислоты
, теплового эффекта образования гидратированных ионов слабой кислоты  и теплового эффекта образования молекул воды
и теплового эффекта образования молекул воды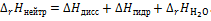


 – промежуточные теплоты разбавления кислоты и основания равные разности соответствующих интегральных теплот растворения:
– промежуточные теплоты разбавления кислоты и основания равные разности соответствующих интегральных теплот растворения:
 – интегральная теплота растворения соответствующая начальной концентрации раствора кислоты,
– интегральная теплота растворения соответствующая начальной концентрации раствора кислоты,  – интегральная теплота растворения соответствующая концентрации раствора кислоты после его разбавления.
– интегральная теплота растворения соответствующая концентрации раствора кислоты после его разбавления.


