Опыт 4. Смещение равновесия и конкурирующие лигандообменные процессы
1. В две пробирки № 7и № 8 добавьте по 5 мл раствора из колбы № 1 (C L = 0,020 моль/л, C Fe = 0,001 моль/л). В пробирку № 7 добавьте 5 мл 0,02 М раствора KCl, в пробирку № 8 добавьте 5 мл 0,02 M раствора KF. Что наблюдаете? 2. Используя справочные данные (опыт 1), сравните устойчивость роданидных, хлоридных и фторидных комплексов железа. Происходит ли образование хлоридных комплексов в растворе пробирки № 7? Основываясь на принципе Ле Шателье–Брауна, объясните наблюдаемые в пробирке № 7 изменения. 3. Определите наиболее устойчивый фторидный комплекс железа(III), напишите реакцию его образования, исходя из [Fe(SCN)3] и KF в молекулярном и ионном виде. Запишите через равновесные концентрации выражение для константы равновесия К с этого процесса, а также выразите ее через известные величины общих констант образования роданидного и фторидного комплексов, приведите численное значение константы равновесия. Рассчитайте равновесный состав раствора пробирки № 8. Теоретические вопросы 1. Дайте качественную характеристику термодинамического равновесия закрытой системы, в которой протекает химическая реакция. 2. Как можно определить, что в системе наступило равновесие? 3. Выразите константу равновесия реакции АВ(г) = А(г) + B(г) через степень диссоциации АВ и давление. 4. Выведите соотношения между Кр и Кс для равновесия: 2SО2(г) + О2(г) 5. Преобразуйте соотношение Δ G ° = Δ H ° – T Δ S ° = – RТ ln K тaк, чтобы было видно, как температура влияет на константу равновесия. 6. Предложите способ расчёта Δ G °, Δ Н ° и Δ S ° на основе известных значений констант равновесия исследуемой химической реакции при двух температурах. 7. Константа равновесия некоторой реакций при 293 К равна 5·10-3, а при 1000 К составляет 2 ·10-6. Определите (без расчётов) знак Δ Н этой реакции. 8. При повышении температуры давление в системе 2СО + О2 9. Для каких из указанных реакций уменьшение объёма сосуда приведёт к смешению равновесия в том же направлении, что и понижение температуры? а) N2(г) + О2(г) б) СО2(г) + С(т) в) 2СО(г) + О2(г) г) СО(г) + Н2О(г) 10. Написать выражения константы равновесия для следующих реакций, протекающих по уравнениям: а) FeO(т) + Н2(г) б) 2СO(г) в) 2Сu(т) + O2(г)
|

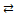 2SО3(г).
2SО3(г). 2СО2 повышается. Определите знак изменения энтальпии реакции.
2СО2 повышается. Определите знак изменения энтальпии реакции. 2NO(г), Δ Н > 0;
2NO(г), Δ Н > 0;


