УРОВЕНЬ В. 1. Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия (K2CO3)
1. Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия (K2CO3). Вычислить константу, степень и рН гидролиза соли в 0, 01М растворе.
K2 CO3 + H2O < => KHCO3 + KOH
Kг = Kг =
pH+ рОН=14. Так как среда щелочная, то определяем pОН= -1/2∙ lgKг -1/2∙ lg рН = 14-рОН, рН = 14-2, 84=11, 16, Ответ: 2. Рассчитать при температуре 300К константу, степень и рН гидролиза нитрат аммония (NH4NO3) в 1М растворе, используя значения термодинамических характеристик реакции гидролиза соли. Написать ионно-молекулярное и молекулярное уравнение гидролиза этой соли. ∆ гНо(298 К) = 51, 14 кДж; ∆ гSo(298 K) = - 4, 67 Дж/К.
NH4 NO3 + H2O < => NH4OH + HNO3
NH4 + + H OH < => NH4OH +, pH< 7, среда
Т.к. среда кислая, то определяем рН:
рН = -1/2∙ (-9, 15)-1/2∙ lg1= 4, 60. Ответ: 3. Какая из двух солей хлорид цинка (ZnCl2) или хлорид меди (СuCl2), при равных концентрациях в большей степени подвергается гидролизу? Ответ мотивировать расчетом отношения степеней гидролиза обеих солей. Составить ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Zn (OH)2 + HCl
Cu Cl2 + H2O < = > CuOHCl + HCl
Cu2+ + H OH < = > +, рН < 7 - среда
= Ответ: Степень гидролиза CuCl2 в 10, 85 раз больше степени гидролиза ZnCl2, поэтому CuCl2 в большей степени подвергается гидролизу, чем ZnCl2.
|

 Kг -? h -? pH-?
Kг -? h -? pH-?

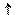

 щелочная
щелочная ,
, (табл.).
(табл.). ,
, ,
,  =0, 14,
=0, 14, :
: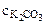 =
= 2, 84
2, 84
 T=300K
Kг-? h-? pH-?
T=300K
Kг-? h-? pH-?


 NH 4OH + HNO3
NH 4OH + HNO3 кислая
кислая (8.1)
(8.1)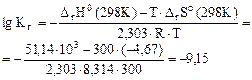
 ,
, =2, 67· 10-5
=2, 67· 10-5
 ,
,




 кислая
кислая

 кислая
кислая
 ,
,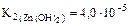 (табл.).
(табл.).

 (табл.)
(табл.) =
=  =
=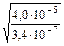 = 10, 85.
= 10, 85.


