УРОВЕНЬ В
1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 1· 10-3М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.
Хлорид цинка диссоциирует по уравнению: ZnCl2 = Zn2+ + 2Сl-.
α = 1 (ZnCl2 – сильный электролит), Хлорид хрома (III) диссоциирует по уравнению: CrCl3 = Cr3+ + 3Сl-
α = 1 (CrCl3 – сильный электролит),
Так как
Составляем схему ГЭ: А (-) Cr │ CrCl3 │ │ ZnCl2 │ Zn (+) K
А (-) Cr │ Cr3+ │ │ Zn2+ │ Zn (+) K Составляем уравнения электродных процессов и суммарной токообразующей реакции:
На A(-)Cr – 3ē = Cr3+ 2 На К(+)Zn2+ + 2ē = Zn 3
2Cr + 3Zn2+ = 2Cr3+ + 3Zn - суммарное ионно-молекулярное уравнение токообразующей реакции 2Cr + 3ZnCl2 = 2CrCl3 + 3Zn - суммарное молекулярное уравнение токообразующей реакции. Рассчитываем напряжение ГЭ:
Ответ: ε = 0, 04В. 2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni2+ = Fe2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆ fG0(298К, Men+) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К. ∆ fG0 (298 К, Ni2+) = - 64, 4 кДж/моль; ∆ fG0 (298 К, Fe2+) = - 84, 94 кДж/моль.
НОК ДМ
На К(+)Ni2+ + 2ē = Ni 1 - восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель. Составляем схему ГЭ: А(-) Fe │ Fe2+ ║ Ni2+ │ Ni(+)K Рассчитываем стандартное напряжение ГЭ: ∆ rG0 (298 К) = - z∙ F∙ ε 0, ε 0 = z = 2, F = 96500 Кл/моль. Рассчитываем константу равновесия токообразующей реакции (Кc).
lgKс = Kс = 103, 6 = 3981 Ответ: ε 0 = 0, 106В, Kс = 3981. 3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии. а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0, 5 см3 газа (н.у.). б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3, 7∙ 10-3 г. Плотность железа равна 7, 9 г/см3. РЕШЕНИЕ: По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:
Так как Составим схему коррозионного ГЭ: А (-) Fe │ HCl │ Ni (+) K или А (-) Fe │ H+ │ Ni (+) K Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии: На A Fe – 2ē = Fe2+
Fe + 2H+ = Fe2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии. Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии. а)
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород. Следовательно, V(газа) = Тогда, KV = 10-4 – коэффициент пересчета, см2 в м2. Рассчитываем весовой показатель коррозии Km по формуле: Km = В процессе коррозии разрушению подвергается железо и выделяется водород. Следовательно: Мэк(Ме) = Мэк(Fe) =
Km = Ответ: KV = 375 см3/м2∙ час, Km = 0, 94 г/м2∙ час. б)
При расчете Km принимаем: Тогда: Km = Рассчитываем глубинный показатель коррозии по формуле: П = Ответ: Km = 0, 925 г/м2∙ час, П = 1, 03 мм/год.
|



 ε -?
ε -?
 = - 0, 76 В,
= - 0, 76 В,  = - 0, 74В.
= - 0, 74В. =
= 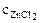 ∙ α ∙
∙ α ∙  = 1∙ 1∙ 1 = 1 моль/л,
= 1∙ 1∙ 1 = 1 моль/л, = -0, 76В.
= -0, 76В. =
=  ∙ α ∙
∙ α ∙  = 10-3∙ 1∙ 1 = 10-3 моль/л,
= 10-3∙ 1∙ 1 = 10-3 моль/л, =
=  = -0, 74 +
= -0, 74 +  lg10-3= -0, 80В
lg10-3= -0, 80В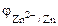 , то в ГЭ анодом будет являться хром, катодом – цинк.
, то в ГЭ анодом будет являться хром, катодом – цинк.

 =
=  = -0, 76-(-0, 80)= 0, 04В
= -0, 76-(-0, 80)= 0, 04В ε 0 -? Кс -?
ε 0 -? Кс -?

 = ∆ fG0 (298 К, Fe2+) - ∆ fG0 (298 К, Ni2+) =
= ∆ fG0 (298 К, Fe2+) - ∆ fG0 (298 К, Ni2+) =
 = - 2, 303∙ R∙ T∙ lgKc;
= - 2, 303∙ R∙ T∙ lgKc;
 = - 0, 44В,
= - 0, 44В,  = - 0, 26В.
= - 0, 26В. На К 2Н+ + 2ē = Н2
На К 2Н+ + 2ē = Н2

 , см3/м2∙ час.
При расчете KV принимаем: S – [м2], τ - [час], V(газа) – [см3].
, см3/м2∙ час.
При расчете KV принимаем: S – [м2], τ - [час], V(газа) – [см3].
 .
. =
=  375 см3/м2∙ час.
375 см3/м2∙ час. , г/м2∙ час.
, г/м2∙ час. =28 г/моль,
=28 г/моль,
 = 11200 см3/моль.
= 11200 см3/моль. = 0, 94 г/м2∙ час.
= 0, 94 г/м2∙ час.
 = 3, 7· 10-3 г.
S = 20 см 2
ρ Fe = 7, 9 г/см3
Km -?
П -?
= 3, 7· 10-3 г.
S = 20 см 2
ρ Fe = 7, 9 г/см3
Km -?
П -?
 , г/м2∙ час.
Коррозии подвергается железо. Тогда потеря массы металла
, г/м2∙ час.
Коррозии подвергается железо. Тогда потеря массы металла 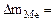
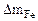 .
.
 - [г]; S – [м2], τ - [час].
- [г]; S – [м2], τ - [час]. =
=  = 0, 925 г/м2∙ час.
= 0, 925 г/м2∙ час. =
=  мм/год.
мм/год.


