Г брома
КCr+3O2 + Br20 + KOH = KBr восст. окисл. среда
3Br20 + 2Cr+3 = 6Br 2KCrO2 + 3Br2 + 6KOH → 6KBr + K2Cr2O7 + 3H2O Согласно уравнению реакции 2 моль KCrO2 реагирует с 3 моль Br2, т.е. 2М
Ответ: окислитель – Br2, восстановитель – KCrO2, 2. Уравнять реакцию. Указать окислитель и восстановитель: H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O Определить cэк(Н2S), если на взаимодействие с 3, 16 г KMnO4 израсходовано 200 см3 раствора H2S.
РЕШЕНИЕ:
H2S-2 + KMn+7O4 + H2SO4 = S0 + Mn+2SO4 + K2SO4 + H2O восст. окисл. cреда НОК ДМ
окисл-ль Mn+7 + 5ē = Mn+2 2
5S-2 + 2Mn+7 = 5S0 + 2Mn+2 Переносим полученные коэффициенты в молекулярное уравнение: 5H2S + 2KMnO4 + H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O Подсчитываем количество H2SO4 необходимое для получения 2 моль MnSO4 и 1 моль K2SO4. Для этого необходимо 3 моль H2SO4: 5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O Уравниваем количество водорода и кислорода (8Н2О): 5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O По закону эквивалентов nэк(H2S) = nэк(KMnO4)
где
Ответ: окислитель - KMnO4, восстановитель - Н2S, 3. Определить направление протекания реакции: а) KI-1 + Cu+2Cl2 < => Cu+Cl + KCl + I20 б) KI-1 + Fe+3Cl3 < => Fe+2Cl2 + KCl + I20
|

 Уравнять реакцию и указать окислитель и восстановитель.
Уравнять реакцию и указать окислитель и восстановитель.
 -?
-?

 + K2Cr2+6O7 + H2O
+ K2Cr2+6O7 + H2O НОК ДМ
НОК ДМ окисл-ль Br20 + 2ē = 2Br - 3
окисл-ль Br20 + 2ē = 2Br - 3 восст-ль Cr+3 - 3ē = Cr+6 2
восст-ль Cr+3 - 3ē = Cr+6 2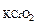 – 3М
– 3М  2· 123 г/моль - 3· 160 г/моль
2· 123 г/моль - 3· 160 г/моль
 =
=  = 2, 05 г
= 2, 05 г = 2, 05г.
= 2, 05г.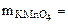 3, 16 г
3, 16 г
 = 200 см3
= 200 см3
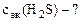


 =
=  , г/моль
, г/моль - число электронов, принятых одной молекулой KMnO4.
- число электронов, принятых одной молекулой KMnO4. =
= 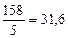 г/моль
г/моль ·0, 2 =
·0, 2 =  = 0, 1
= 0, 1 =
=  = 0, 5 моль/л
= 0, 5 моль/л



