УРОВЕНЬ В. 1. Определить давление насыщенного пара воды над 0,05 М раствором хлорида кальция (ρ = 1,041 г/см3) при 301К
1. Определить давление насыщенного пара воды над 0, 05 М раствором хлорида кальция (ρ = 1, 041 г/см3) при 301К, если давление насыщенного пара над водой при этой температуре равно 3, 78 кПа. Кажущаяся степень диссоциации хлорида кальция равна 0, 85.
где
i – изотонический коэффициент. α = где α – кажущаяся степень диссоциации CaCl2 к – общее количество ионов, образующихся при полной диссоциации одной молекулы CaCl2. CaCl2 = Сa2+ + 2Cl- к = 3 i = 0, 85(3-1)+1 = 2, 7
oткуда
Для расчета берем 1л раствора
mр-ра = Vр-ра· ρ = 1000∙ 1, 041 = 1041г.
р = 3, 78∙ Ответ: давление насыщенного пара над раствором равно 3, 77 кПа. 1. Определить осмотическое давление 1, 5% раствора карбоната натрия при 250С. Плотность раствора равна 1, 015 г/см3. Кажущаяся степень диссоциации карбоната натрия равна 0, 9.
где α - кажущаяся степень диссоциации, к – общее количество ионов, образующихся при полной диссоциации одной молекулы Na2CO3 Na2CO3 = 2Na+ + CO32- к = 3, тогда i = 0, 9(3-1)+1 = 2, 8
В 100 г 1, 5%-ного раствора содержится 1, 5 г Na2CO3 Vр-ра =
π = 2, 8∙ 0, 144∙ 8, 314∙ 298 = 998, 96 кПа Ответ: осмотическое давление 1, 5% раствора Na2CO3 равно 998, 96 кПа.
3. Определить кажущуюся степень диссоциации соли, если водный раствор хлорида алюминия с массовой долей 1, 5% кристаллизуется (замерзает) при температуре (-0, 690С).
AlCl3 = Al3+ + 3Cl- к = 4 ∆ tзам = i∙
где сm(AlCl3) = В 100г 1, 5%-ного раствора содержится 1, 5г AlCl3 и 98, 5 г воды. сm(AlCl3) =
α = Ответ: кажущаяся степень диссоциации AlCl3 равна 0, 75(75%).
|

 моль/л
T = 301К
ρ = 1, 041 г/см3
α = 0, 85
рo = 3, 78 кПа
р -?
моль/л
T = 301К
ρ = 1, 041 г/см3
α = 0, 85
рo = 3, 78 кПа
р -?


 , (6.4)
, (6.4)
 - количество воды, моль,
- количество воды, моль, - количество CaCl2, моль
- количество CaCl2, моль , i = α (к-1) + 1 (6.5)
, i = α (к-1) + 1 (6.5)
 , моль/л, (6.6)
, моль/л, (6.6) , г
, г = 111 г/моль
= 111 г/моль

 = 3, 77 кПа.
= 3, 77 кПа.
 = 1, 5%
t = 250С
ρ = 1, 015 г/см3
α = 0, 9
π -?
= 1, 5%
t = 250С
ρ = 1, 015 г/см3
α = 0, 9
π -?
 ∙ R∙ T, кПа (6.7)
α =
∙ R∙ T, кПа (6.7)
α =  , моль/л
, моль/л =
=  = 98, 5см3 = 0, 0985 л.
= 98, 5см3 = 0, 0985 л. = 0, 144 моль/л
= 0, 144 моль/л =1, 86 кг· К/моль.
=1, 86 кг· К/моль.
 = 1, 5%
tзам р-ра = -0, 690С
= 1, 5%
tзам р-ра = -0, 690С
 ,
где к – общее количество ионов, образующихся при полной диссоциации одной молекулы AlCl3
,
где к – общее количество ионов, образующихся при полной диссоциации одной молекулы AlCl3

 , моль/кг
, моль/кг = 0, 114 моль/кг,
= 0, 114 моль/кг, = 133, 5 г/моль
= 133, 5 г/моль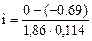 = 3, 25
= 3, 25 = 0, 75 (75%)
= 0, 75 (75%) 7. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ.
7. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ.


