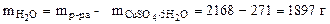В) молярную долю кислоты в растворе
Согласно условию задачи в 100 г раствора содержится 6 г Н3РО4. Тогда 6 г Н3РО4 содержится в объеме раствора
Следовательно, где 10-3 - пересчет см3 в л. б) моляльность кислоты в растворе определяем по формуле:
Тогда где 1000 - коэффициент пересчета г в кг. в) молярную долю кислоты определяют по формуле:
2. Определить объем 16%-ного раствора карбоната калия плотностью 1, 149 г/см3, необходимого для приготовления 3 л 0, 2 М водного раствора данного вещества. Пояснить процесс приготовления раствора.
Следовательно:
Рассчитываем массу 16%-ного раствора К2СО3, который содержит 82, 8 г К2СО3. Составляем пропорцию: 100 г р-ра - 16 г К2СО3 mр-ра(16%) - 82, 8 г К2СО3. mр-ра(16%) = Определим объём 16% - ного раствора:
Ответ: для приготовления 3 л 0, 2 М раствора К2СО3 нужно взять 450, 4 мл 16%-ного раствора К2СО3 и разбавить его водой до 3 л.
3. Найти массы воды и кристаллогидрата CuSO4·5H2O, необходимые для приготовления 2 литра раствора, содержащего 8% мас. безводной соли. Плотность 8%-го раствора CuSO4 равна 1, 084 г/см3.
откуда Масса раствора равна
Массу CuSO4·5H2O, содержащую 86, 7 г CuSO4, определяем из пропорции:
где
Тогда
Зная массу раствора и кристаллогидрата, определяем массу воды, необходимую для приготовления заданного раствора:
Ответ:
|



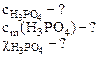
 ;
; = 1·3 +31+16·4 =98 г/моль
= 1·3 +31+16·4 =98 г/моль ,
,


 = =
= = 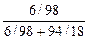 = 0, 011
= 0, 011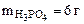






 = 2·39 + 12 +16·3 =138 г/моль
= 2·39 + 12 +16·3 =138 г/моль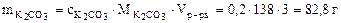
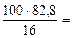 517, 5 г,
517, 5 г,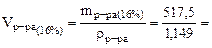 450, 4 см3
450, 4 см3 = 8%
ρ р-ра= 1, 084 г/см3
= 8%
ρ р-ра= 1, 084 г/см3
 , %
, %



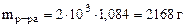 , где 103 коэффициент перевода л в см3. Тогда масса CuSO4 в растворе составляет:
, где 103 коэффициент перевода л в см3. Тогда масса CuSO4 в растворе составляет: ,
, 250 г/моль -160 г/моль
250 г/моль -160 г/моль 
 - 173, 4 г
- 173, 4 г = 64+32+16·4=160 г/моль
= 64+32+16·4=160 г/моль = 64+32+16·4 +5·(1·2+16)=250 г/моль
= 64+32+16·4 +5·(1·2+16)=250 г/моль