УРОВЕНЬ В. 1. Рассчитать рН раствора, полученного смешением 25 см3 0,1М раствора HCl, 20 см3 0,2М раствора NaOH и 50 см3 воды. Дано: = 20см3
1. Рассчитать рН раствора, полученного смешением 25 см3 0, 1М раствора HCl, 20 см3 0, 2М раствора NaOH и 50 см3 воды.
РЕШЕНИЕ:
NaOH + HCl → NaCl + H2O (7.5)
Рассчитываем химическое количество исходных веществ:
10-3 – коэффициент перевода мл в л. Из уравнения реакции (7.5) следует, что число моль NaOH, вступившего в реакцию, равно числу моль HCl. Определяем вещество, оставшееся в избытке: 0, 004 моль > 0, 0025 моль. Следовательно, в избытке, который определяет рН среды остался NaOH. Тогда количество избыточного NaOH в растворе:
Учитывая, что суммарный объем раствора складывается из объемов двух растворов и воды,
Молярная концентрация NaOH равна:
Так как диссоциация NaOH протекает по уравнению: NaOH = Na+ + OH-, то
рОН = - lg рН = 14 – рОН, рН = 14-1, 80 = 12, 20. Ответ: рН = 12, 20.
2. Определить, образуется ли осадок, если смешали 100 см
РЕШЕНИЕ: При смешении растворов протекает следующая реакция: СaCl2+Na2CO3= CaCO3↓ + NaCl (7.6) Осадок CaCO с Поскольку смешали 100 cм с CaCl Процессы диссоциации CaCl CaCl Na следовательно, n с с с Так как 4, 29·10-5 > 5·10-9 (ПР Ответ: осадок CaCO 3.Вычислить рН 0, 0IM водного раствора HNO2, содержащего, кроме того, 0, 02 моль/л KNO2.
РЕШЕНИЕ: рН = - lg с HNO2 < => H+ + NO KNO2 = K+ + NO
Прибавление KNO2 к раствору HNO2 смещает равновесие диссоциации HNO2 влево за счет увеличения концентрации иона NO2-. В результате, в системе устанавливается равновесие при новых концентрациях Н+ и NO Тогда обозначим равновесную концентрацию ионов [Н+] в новых условиях через х: [H+] = х моль/л. Общая равновесная концентрация иона [NO [NO из HNO2 из KNO2 Концентрация ионов NO Концентрация ионов NO КNO2 - сильный электролит, α = 1, n тогда [NO Равновесная концентрация недиссоциированных молекул [HNO2] = (0, 01 – х) моль/л.
так как, х < < 0, 01 моль/л, то значением х, ввиду его малого значения, в выражениях (х+0, 02) и (0, 01- х) можно пренебречь, и данное выражение записать в виде:
рН = -lg(2·10-4) = 3, 7 Ответ: рН = 3, 7
|

 = 20см3
= 20см3
 = 0, 2 моль/л
= 0, 2 моль/л
 = 25см3
= 25см3
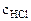 = 0, 1 моль/л
= 0, 1 моль/л
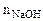 =
= 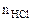 =
= 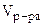 =
= 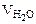 = 25· 10-3 + 20· 10-3 + 50· 10-3 = 95· 10-3л,
= 25· 10-3 + 20· 10-3 + 50· 10-3 = 95· 10-3л,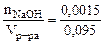 = 0, 016 моль/л.
= 0, 016 моль/л. = 0, 016 моль/л.
= 0, 016 моль/л. = - lg 0, 016 = 1, 80.
= - lg 0, 016 = 1, 80. 0, 01М водного раствора хлорида кальция и 200 см
0, 01М водного раствора хлорида кальция и 200 см  = 0, 01M
с
= 0, 01M
с 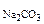 = 0, 02M
V
= 0, 02M
V 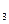 образуется только в случае, если
образуется только в случае, если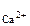 ·с
·с 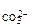 > ПР
> ПР  =5·10
=5·10  (табл.)
(табл.)
 и 200 cм
и 200 cм  с
с 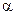 ·n
·n  с
с 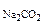 ·
·  +2Cl
+2Cl 
 +CO
+CO 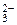
 =
= 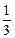 0, 01·1·1 = 3, 3·10
0, 01·1·1 = 3, 3·10 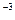 моль/л,
моль/л,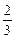 0, 02·1·1 = 1, 3·10
0, 02·1·1 = 1, 3·10 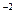 моль/л.
моль/л.
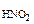 = 0, 01 M
с
= 0, 01 M
с 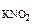 = 0, 02 M
= 0, 02 M
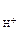
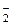 (7.7)
(7.7) (7.8)
(7.8)
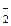 ] равна сумме концентраций иона NO
] равна сумме концентраций иона NO 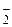 , образовавшегося при диссоциации HNO2 и при диссоциации KNO2:
, образовавшегося при диссоциации HNO2 и при диссоциации KNO2: + с
+ с 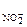 = 0, 2· 1· 1 = 0, 2 моль/л (из уравнения 7.8.),
= 0, 2· 1· 1 = 0, 2 моль/л (из уравнения 7.8.),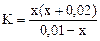 = 4·10-4, (табл.)
= 4·10-4, (табл.)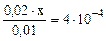 ; откуда х = [H+] = 2 · 10-4 моль/л
; откуда х = [H+] = 2 · 10-4 моль/л


