Вычислить константу равновесия реакции при стандартных условиях
РЕШЕНИЕ: а) Для того, чтобы определить направление протекания окислительно-восстановительной реакции, надо сопоставить силу окислителей для следующих полуреакций (см. таблицу)
Cu2+ + e- = Cu+ φ I2 + 2e- = 2I- φ Из двух приведенных окислителей более сильным окислителем будет I2, поскольку φ I2 находится в продуктах реакции, следовательно, реакция будет протекать справа налево т.е. реально протекающей будет реакция: CuCl + KCl + I2 < => KI + CuCl2 Расставляем коэффициенты методом электронного баланса: Cu+1Cl + KCl + I20 = Cu+2Cl2 + KI-1
Cu+1 - e- = Cu+2 2
I20 + 2Cu+1 = 2Cu+2 + 2I 2CuCl + 2KCl + I2 < => 2KI + 2CuCl2 Δ rG0(298K) = -z·F·ε ˚ (9.1) где z - число отданных или принятых электронов (НОК = 2); ε ˚ = φ ˚ ок - φ ˚ восст (9.2) ε ˚ = Δ rG0(298K) = -2·96500·0, 39 = -75270 Дж,
Ответ: окислитель - I2; восстановитель – CuCl, приведенная в условии задачи реакция (а) протекает справа налево, КС =1, 66· 1013. б) Из таблицы определяем стандартные электродные потенциалы окислителей для реакции KI + FeCl3 < => FeCl2 + KCl + I2 Fe3+ + e- = Fe+2 φ I2 - 2e- = 2I- φ Из двух приведенных окислителей более сильным окислителем будет Fe+3, поскольку φ Fe+3 находится в исходных веществах, следовательно, реакция будет протекать слева направо т.е. реально протекающей будет реакция (б), приведенная в условии задачи: KI + FeCl3 < => FeCl2 + KCl + I2 Расставляем коэффициенты методом электронного баланса: KI-1 + Fe+3Cl3 = Fe+2Cl2 + KCl + I20 НОК ДМ
1 2 Fe+3 + e- = Fe+2 1 2
Поскольку после реакции образуется четное число атомов иода, значения НОК и ДМ удваиваем. 2KI + 2FeCl3 < => 2FeCl2 + 2KCl + I2 Δ rG0(298K) = -z·F·ε ˚ (9.1) где z - число отданных или принятых электронов (НОК = 2); ε ˚ = φ ˚ ок - φ ˚ восст (9.2) ε ˚ = 0, 77-0, 54 = 0, 23В Δ rG0(298K) = -2·96500·0, 23 = -44390 Дж,
Ответ: окислитель – FeCl3; восстановитель – KI, реакция протекает слева направа, Кс =6, 3· 107.
|

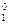 = +0, 15 B
= +0, 15 B = +0, 54 B
= +0, 54 B
 I
I 
 = 0, 54-0, 15 = 0, 39В
= 0, 54-0, 15 = 0, 39В = 1, 66· 1013.
= 1, 66· 1013. = +0, 77 B
= +0, 77 B
 I-1 + Fe+3 = Fe+2 + I0
I-1 + Fe+3 = Fe+2 + I0 = 6, 3· 107.
= 6, 3· 107.


