УРОВЕНЬ В. 1. При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8 см3 водорода
1. При погружении цинковой пластины в раствор хлороводородной кислоты за одно и то же время при температуре 293 К выделилось 8 см3 водорода, а при температуре 303 К – 13 см3 водорода. Водород собран над водой при давлении 740 мм рт. ст. Рассчитать энергию активации протекающей реакции. Давление паров воды при температуре 293 К составляет 17, 54 мм рт. ст., а при температуре 303 К - 31, 82 мм рт. ст.
Скорость гетерогенной реакции определяем по уравнению:
где S – площадь цинковой пластины, см2; τ – время протекания реакции, мин. Определяем отношение скоростей выделения водорода при двух различных температурах (площадь пластины и время протекания реакции постоянны):
По уравнению Менделеева-Клапейрона P (P – P где Р – общее давление газов, мм. рт. ст; P V Т - температура опыта, К; R -универсальная газовая постоянная. Из уравнения (5.6) n Подставив выражение (5.7) для температур Т1 и Т2 в отношение (5.5), получим
= Откуда = 31, 83 кДж/моль Ответ:
2. На основании принципа Ле Шателье определить, в каком направлении сместится равновесие: 2SO2(г) + O2(г) < => 2SO3(г), Δ rH0(298K) = -284, 2 кДж, при: а) понижении температуры, б) повышении концентрации SO3, в) повышении давления. Записать выражение для константы равновесия реакции. Ответы обосновать.
а) Выражение зависимости константы равновесия от термодинамических характеристик реакции имеет вид: -2, 3RTlgKP = Δ rH0(298K) – T . Δ rS0(298K), откуда
б) Константа равновесия в) В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той реакции, которая сопровождается уменьшением давления или уменьшением суммарного числа моль газообразных веществ.
Следовательно, при повышении давления равновесие системы смещается вправо (→). 3. Вычислить константу равновесия для гомогенной системы 4NH3(г) +3O2(г) < => 2N2(г) + 6H2O(г), если исходные концентрации NH3(г) и O2(г) соответственно равны 6, 0 и 5, 0 моль/л, а равновесная концентрация N2(г) равна 1, 8 моль/л.
веществ равна разности исходной концентрации и концентрации прореагировавших веществ. Равновесная концентрация продуктов реакции равна количеству образовавшихся продуктов реакции, т.к. в исходном состоянии их количество было равно нулю. Обозначим через х количество моль прореагировавших или образовавшихся веществ. Тогда с учетом коэффициентов в уравнении реакции отношения концентраций во второй строке под уравнением реакции равны: ( Последовательность расчетов равновесных концентраций веществ, участвующих в реакции, показана ниже:
По условию задачи равновесная концентрация N2 равна 1, 8 моль/л. В то же время [N2] = 2х. Следовательно, 2х = 1, 8, а х = 0, 9. Тогда равновесные концентрации веществ равны, моль/л: [NH3] = 6, 0-4· 0, 9 = 2, 4 моль/л, [O2] = 5, 0-3· 0, 9 = 2, 3 моль/л, [N2] = 1, 8 моль/л, [H2O] = 6, 0· 0, 9 = 5, 4 моль/л.
Ответ: Kс = 198, 95.
6. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
|


 = 8 см3,
= 8 см3,

 = 13 см3,
P
= 13 см3,
P 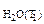 = 21, 07 мм рт.ст.
P
= 21, 07 мм рт.ст.
P  =31, 82 мм рт.ст.
P = 740 мм рт.ст.
=31, 82 мм рт.ст.
P = 740 мм рт.ст.
 τ
τ  -?
-?

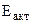 -?
-? выражаем
энергию активации
выражаем
энергию активации
 (5.3)
(5.3)
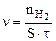 , моль/(см2·мин) (5.4)
, моль/(см2·мин) (5.4) - количество моль выделяющегося водорода;
- количество моль выделяющегося водорода; =
=  :
:  =
=  (5.5)
(5.5)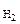 V
V  ), то
), то =
=  :
: 
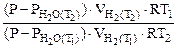

 = 31834 Дж/моль =
= 31834 Дж/моль = = 31, 83 кДж/моль.
= 31, 83 кДж/моль. Определить направление смещения равновесия при изменении Т, Р, С
Определить направление смещения равновесия при изменении Т, Р, С 
 , (5.8)
, (5.8) 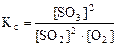 . (5.9)
. (5.9)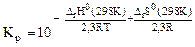 . Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции Δ rH0(298K). Так как Δ rH0(298K)< 0, то при понижении температуры показатель степени
. Смещение равновесия реакции при изменении температуры зависит от знака изменения стандартной энтальпии реакции Δ rH0(298K). Так как Δ rH0(298K)< 0, то при понижении температуры показатель степени  возрастать.
возрастать.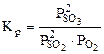 возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) < => 2SO3(г) будет смещено вправо (→).
возрастает при увеличении числителя и уменьшении знаменателя, а это возможно при протекании прямой реакции, т.е равновесие 2SO2(г) + O2(г) < => 2SO3(г) будет смещено вправо (→). остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации SO3 (числитель) при неизменном значении КС должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (←).
остается величиной постоянной при любом изменении концентрации участников реакции. Поэтому при повышении концентрации SO3 (числитель) при неизменном значении КС должны автоматически возрасти концентрации исходных веществ (знаменатель), а это возможно при протекании обратной реакции, т.е. в этом случае равновесие сместится влево (←). (газ)
(газ) = 2моль(газ)
= 2моль(газ)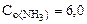 моль/л,
моль/л,
 моль/л,
[N2] = 1, 8 моль/л
Kс -?
моль/л,
[N2] = 1, 8 моль/л
Kс -?

 . (5.11)
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных
. (5.11)
Расчет количеств прореагировавших и образовавшихся при установлении равновесия веществ проводится по уравнению реакции.
Равновесная концентрация исходных
 :
:  :
:  :
:  = 4: 3: 2: 6).
= 4: 3: 2: 6). 6, 0
6, 0



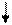

 + 6х
+ 6х

 =198, 95.
=198, 95.


